
回答下面问题:
(1)在进行沉淀反应的实验时,如何认定沉淀已经完全?
_____________________________________________________________________________________________________________________________________________________________________________________________________________________.
(2)中学化学实验中,在过滤器上洗涤沉淀的操作是
_____________________________________________________________________________________________________________________________________________________________________________________________________________.
(1)在上层清液中(或取少量上层清液置于小试管中),滴加沉淀剂,如果不再产生沉淀,说明沉淀已经完全 (2)向漏斗里注入蒸馏水,使水面没过沉淀物,等水流完后,重复操作数次
|
一般情况下,在沉淀反应中,要想使沉淀完全,沉淀剂应是过量的.检查沉淀是否完全的方法,可以等沉淀下沉后,直接在上层清液中再继续滴加少量沉淀剂,如果不再有新的沉淀生成,说明沉淀已经完全。 过滤得到的沉淀上常常吸附和包藏有沉淀剂的离子和溶液中的其他离子.这就会使实验结果产生误差.因此在做定量分析时,滤出的沉淀还需要洗涤.中学化学实验中,在过滤器上洗涤沉淀的操作是:往漏斗里注入少量蒸馏水,使水面没过沉淀物,等水流出后,再次加水,重复数次直到由漏斗流出的滤液中不再含有应该除去的离子时为止.
|


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
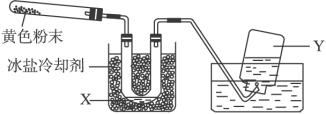
回答下面问题:
(1)在装置中试管和U形管上的橡皮塞最好用锡箔包住,用橡皮管连接的两玻璃管口要相互紧靠,原因是_________________________________________。
(2)液体X可能是__________;气体Y可能是_____________。
(3)导管口不再有气泡冒出时,停止反应,这时在操作上应注意________________________,理由是________________________。
(4)用简单的实验证实(2)中的判断。
①对X的判断:_______________________________________。
②对Y的判断:_______________________________________。
(要求:怎样从水槽中取出集气瓶、实验方法、现象、结论)
查看答案和解析>>
科目:高中化学 来源: 题型:
①称量a g样品,置于烧杯中;
②加入适量蒸馏水,使样品溶解;
③加入稀盐酸,使溶液呈强酸性,再加过量的BaCl2溶液;
④过滤,用蒸馏水洗涤沉淀;
⑤加热干燥沉淀物;
⑥将沉淀物冷却至室温后,称量;
⑦重复⑤⑥操作直到合格,最后得到b g固体。
回答下面问题:
(1)本实验中是否能用Ba(NO3)2代替BaCl2?________,其理由是________________。
(2)步骤③中加盐酸使溶液呈强酸性的目的是________________________。
(3)步骤⑦的“合格”标准是________________。
(4)实验测得样品中无水亚硫酸钠的质量分数是________ (列出算式,不需化简)。
查看答案和解析>>
科目:高中化学 来源: 题型:
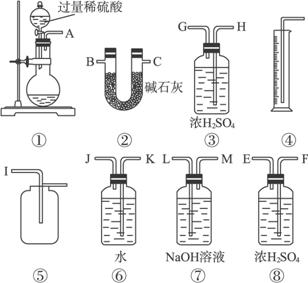
请回答下面问题:
(1)甲同学想通过实验测得的数据是_________。他使用装置③_______(填“有”或“没有”)必要。
(2)乙同学想通过实验测得的数据是_________。按他测得的数据计算出的实验结果_________。(填“偏高”或“偏低”),理由是____________________________________________。
(3)为了测得准确的实验数据,请你将乙同学的实验装置进行改进(每种仪器只准使用一次),写出各仪器接口的连接顺序:___________________________。
(4)按你设计的实验装置进行实验,若测得实验前后装置②的质量分别是W1和W2,则样品中过碳酸钠的质量分数为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
描述弱电解质电离情况可以用电离度和电离平衡常数表示,下表是常温下几种弱电解质的电离平衡常数:
| 酸或碱 | 电离常数(Ka或Kb) |
| CH3COOH | 1.8×10-5 |
| HNO2 | 4.6×10-4 |
| HCN | 5×10-10 |
| HClO | 3×10-8 |
| NH3·H2O | 1.8×10-5 |
请回答下面问题:
(1)上述四种酸中,酸性最弱的是_______ (用化学式表示)。下列能使醋酸
溶液中CH3COOH的电离程度增大,而电离常数不变的操作是_____ (填序号)。
A.升高温度
B.加水稀释
C.加少量的CH3COONa固体
D.加少量冰醋酸
(2)CH3COONH4的水溶液呈_____ (选填“酸性”“中性”或“碱性”),理由是____________________________,溶液中各离子浓度大小的关系是_____________________。
(3)物质的量1∶1的NaCN和HCN的混合溶液,其pH>7,该溶液中离子的浓度从大
到小排列为____________________________。
(4)已知一些难溶物的溶度积常数如下表:
| 物质 | FeS | MnS | Cus | PbS | HgS | ZnS |
| Ksp | 6.3×10-18 | 2.5×10-13 | 1.3×10-36 | 3.4×10-28 | 6.4×10-55 | 1.6×10-24 |
某工业废水中含有Cu2+、Pb2+、Hg2+,最适宜向此工业废水中加入过量的 除去它们。(选填序号)
①NaOH ②FeS ③Na2S
查看答案和解析>>
科目:高中化学 来源:2013届山东省潍坊市高二寒假作业化学(三)试卷 题型:填空题
描述弱电解质电离情况可以用电离度和电离平衡常数表示,下表是常温下几种弱电解质的电离平衡常数:
|
酸或碱 |
电离常数(Ka或Kb) |
|
CH3COOH |
1.8×10-5 |
|
HNO2 |
4.6×10-4 |
|
HCN |
5×10-10 |
|
HClO |
3×10-8 |
|
NH3·H2O |
1.8×10-5 |
请回答下面问题:
(1)上述四种酸中,酸性最弱的是_______ (用化学式表示)。下列能使醋酸
溶液中CH3COOH的电离程度增大,而电离常数不变的操作是_____ (填序号)。
A.升高温度
B.加水稀释
C.加少量的CH3COONa固体
D.加少量冰醋酸
(2)CH3COONH4的水溶液呈_____ (选填“酸性”“中性”或“碱性”),理由是____________________________,溶液中各离子浓度大小的关系是_____________________。
(3)物质的量1∶1的NaCN和HCN的混合溶液,其pH>7,该溶液中离子的浓度从大
到小排列为____________________________。
(4)已知一些难溶物的溶度积常数如下表:
|
物质 |
FeS |
MnS |
Cus |
PbS |
HgS |
ZnS |
|
Ksp |
6.3×10-18 |
2.5×10-13 |
1.3×10-36 |
3.4×10-28 |
6.4×10-55 |
1.6×10-24 |
某工业废水中含有Cu2+、Pb2+、Hg2+,最适宜向此工业废水中加入过量的 除去它们。(选填序号)
①NaOH ②FeS ③Na2S
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com