
| A、将纳米Fe3O4分散在水中没有丁达尔现象 |
| B、将纳米Fe3O4分散在水中Fe3O4不能透过滤纸 |
| C、每生成1 mol Fe3O4反应转移的电子数为4 NA |
| D、反应物OH-的化学计量数x=2 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
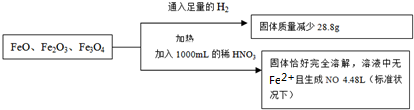
| A、3.8mol?L-1 |
| B、4.0mol?L-1 |
| C、4.4mol?L-1 |
| D、3.6mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢气与氯气见光发生爆炸,说明氢气与氯气具有的总能量小于氯化氢 |
| B、浓硝酸在光照条件下变黄,说明浓硝酸不稳定,有有色物质生成且能溶于浓硝酸 |
| C、由于碳燃烧时放出大量的热,所以碳与氧气的反应不需要任何条件 |
| D、将铜片放入浓硫酸中,无明显实验现象,说明铜在冷的浓硫酸中发生钝化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属钠和水的反应:Na+2H2O=Na++OH-+H2↑ |
| B、向次氯酸钙溶液中通入SO2:Ca2++2ClO-+H2O+SO2=CaSO3+2HClO |
| C、过量的铁与浓硝酸反应:Fe+6H++3NO3-=Fe3++3NO2↑+3H2O |
| D、过量的NaHSO4溶液与Ba(OH)2溶液反应:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、澄清石灰水与稀盐酸反应Ca(OH)2+2H+=Ca2++2H20 |
| B、碳酸钠溶液与盐酸反应Na2CO3+2H+?=2Νa++H2O+CO2↑ |
| C、氢氧化铜与稀硫酸反应Cu(OH)2+2H+=Cu2++2H2O |
| D、稀硫酸与氢氧化钡溶液反应H++OH-+Ba2++SO42-=H2O+BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
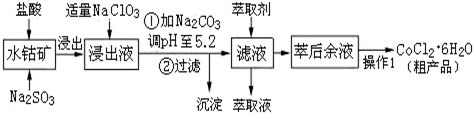
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、7.8g Na2S和7.8g Na2O2中含有阴离子的数目均为0.1NA |
| B、相同物质的量的OH-和CH3+含有相同数目的电子 |
| C、NA个H2分子与0.5NA个CO分子所占的体积比一定是3:1 |
| D、25℃,pH=13的NaOH溶液中,含有OH-的数目为0.1NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com