
【题目】CO是现代化工生产的基础原料,下列有关问题都和CO的使用有关。
(1) 利用CO生产乙醇: 2CO(g)+4H2(g)![]() CH3CH2OH(g)+H2O(g) ΔH1
CH3CH2OH(g)+H2O(g) ΔH1
又已知:H2O(l)=== H2O(g)ΔH2 CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH3
CO2(g)+H2(g) ΔH3
工业上也可利用CO2(g)与H2(g)为原料合成乙醇:2CO2(g)+6H2(g)![]() CH3CH2OH(g)+3H2O(l) ΔH
CH3CH2OH(g)+3H2O(l) ΔH
则:ΔH与ΔH1、ΔH2、ΔH3之间的关系是:ΔH=_______________________。
(2)一定条件下,H2、CO在体积固定的密闭容器中发生如下反应:4H2(g)+2CO(g)![]() CH3OCH3(g)+H2O(g),
CH3OCH3(g)+H2O(g),
下列措施中能够同时满足增大反应速率和提高CO转化率的是________(填字母)。
A.使用高效催化剂 B.降低反应温度
C.增大体系压强 D.不断将CH3OH从反应混合物中分离出来
(3)采用CO与H2反应合成再生能源甲醇,反应如下:
CO(g)+ 2H2(g)![]() CH3OH(g)
CH3OH(g)
在一容积可变的密闭容器中充有10molCO和20mol H2,在催化剂作用下发生反应生成甲醇。CO的平衡转化率(α)与温度(T)、压强(p)的关系如(图1)所示。
①合成甲醇的反应为______(填“放热”或“吸热”)反应。
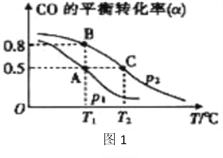
②A、B、C三点的平衡常数KA、KB、KC的大小关系为__________。
③若达到平衡状态A时,容器的体积为10L,则在平衡状态B时容器的体积为_______________L。
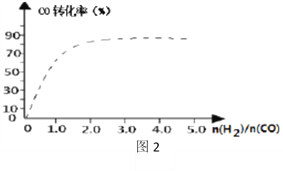
④(图2)中虚线为该反应在使用催化剂条件下关于起始氢气与CO投料比和CO平衡转化率的关系图。当其条件完全相同时,用实线画出不使用催化剂情况下CO平衡转化率的示意图.____________
【答案】 ΔH1 -2△H3-3△H2 C 放热 KA=KB>KC 2 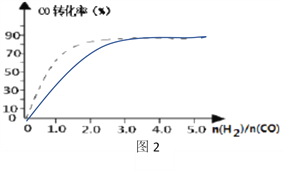
【解析】(1)已知:①2CO(g)+4H2(g)CH3CH2OH(g)+H2O(g)△H1,②H2O(1)═H2O(g)△H2,③CO(g)+H2O(g)CO2(g)+H2(g)△H3,根据盖斯定律,则①-②×3-③×2得2CO2(g)+6H2(g)CH3CH2OH(g)+3H2O,则:△H=△H1-3△H2-2△H3,故答案为:△H1-3△H2-2△H3;
(2)A、使用高效催化剂只能增大反应速率,不能改变平衡移动,所以CO的转化率不变,故错误;B、降低反应温度会减慢反应速率,故错误;C、增大压强,反应速率增大,该反应属于气体体积减小的反应,增大压强,平衡向正反应方向移动,CO的转化率增大,故正确;D、不断将CH3OH从反应混合物中分离出来,即减小生成物的浓度,则反应速率减小,故错误;故答案为:C;
(3)①据图象可知,温度升高,CO的平衡转化率减小,平衡逆向移动,即逆反应方向为吸热,所以正反应方向为放热;故答案为:放热;
②因B点与A点温度相同,K不变,即KA=KB,该反应正反应属于放热反应,温度升高,平衡向逆反应方向移动,平衡常数减小,所以A、B、C三点的平衡常数KA=KB>KC,故答案为:KA=KB>KC;
③T1时,A点对应的α=0.5,
CO(g)+2H2(g)CH3OH(g)
起始(mol) 10 20 0
转化(mol) 5 10 5
平衡(mol) 510 5
平衡常数K= =1,因B点与A点温度相同,K不变,B点对应的α=0.8,
=1,因B点与A点温度相同,K不变,B点对应的α=0.8,
CO(g)+2H2(g)CH3OH(g)
起始(mol) 10 20 0
转化(mol) 8 16 8
平衡(mol) 24 8
则K=![]() =
=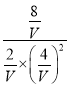 =1,解得:V=2L,故答案为:2;
=1,解得:V=2L,故答案为:2;
④使用催化剂,加快反应速率,达到平衡需要的时间减少,但是不会引起平衡的移动,当不使用催化剂,反应速率减慢,达到平衡需要的时间增大,但平衡状态相同,因此起始H2,CO投料比和CO平衡转化率的关系示意图如下: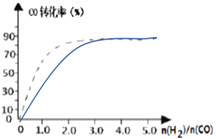 ,故答案为:
,故答案为: 。
。


科目:高中化学 来源: 题型:
【题目】20℃,反应N2O4![]() 2NO2 △H>0在密闭容器中达平衡,下列说法不正确的
2NO2 △H>0在密闭容器中达平衡,下列说法不正确的
A. 体积不变时加入少许NO2,再度平衡时颜色变深
B. 体积不变时加入少许N2O4,平衡正向移动,N2O4转化率减小
C. 容器体积减小时,平衡逆向移动,正反应速率减小,逆反应速率增大
D. 体积不变时升高温度,再度平衡时颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C 分别代表中学化学中的常见物质,请根据题目要求回答下列问题:
(1)实验室常用A的饱和溶液制备微粒直径为1nm-100nm的红褐色液相分散系。则该反应的化学方程式为:_________________________,将A 的溶液加热蒸干并灼烧,得到固体的化学式为:________。
(2)B为地壳中含量最高的金属元素的氯化物,向50.0mL,4mol/L的B溶液中逐滴滴入100mL 某浓度的KOH溶液,若产生7.8g白色沉淀,则加入的KOH溶液的浓度可能为_________________________。
(3)将A、B中两种金属元素的单质用导线连接,插入同一个盛有KOH溶液的烧杯中构成原电池,则负极发生的电极反应为:_____________________________________。
(4)C是常见温室气体,将一定量的气体C通入100mL某浓度的KOH溶液得溶液F,向F溶液中逐滴加入2 mol·L-1的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示。

则F 溶质与足量石灰水发生反应最多可得沉淀的质量为_______________g。
(5)pH=3.6时,碳酸钙与硫酸铝反应可制备碱式硫酸铝[Al2(SO4)x(OH)6-2x]溶液。若溶液的pH偏高,则碱式硫酸铝产率降低且有气体C产生,用化学方程式表示其原因: ______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将钠、镁、铝各0.3 mol分别放入足量的盐酸中,同温同压下产生的气体的体积比是( )
A.1∶1∶1 B.1∶2∶3 C.6∶3∶2 D.3∶1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实能用勒夏特列原理来解释的是
A. SO2氧化SO3,往往需要使用催化剂2SO2(g)+O2(g)![]() 2SO3(g)
2SO3(g)
B. 500 ℃左右的温度比室温更有利于合成氮反应N2(g)+ 3H2 (g)![]() 2NH3(g) △H<0
2NH3(g) △H<0
C. H2、I2、HI平衡混合气体加压后颜色加深H2(g)+ I2(g)![]() 2HI(g)
2HI(g)
D. 光照使氯水变质 Cl2+H2O![]() H++Cl-+HClO
H++Cl-+HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】AlN广泛应用于电子、陶瓷等工业领域。在一定条件下,AlN可通过反应Al2O3+N2+3C![]() 2AlN+3CO合成。下列叙述正确的是( )
2AlN+3CO合成。下列叙述正确的是( )
A. AlN为氧化产物
B. AlN的摩尔质量为41g
C. 上述反应中,每生成1molAlN需转移3mol电子
D. 上述反应中,N2是还原剂,Al2O3是氧化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一容积不变的密闭容器中充入一定量A和B,发生如下反应:xA(g)+2B(s) ![]() yC(g) ΔH<0,一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如图所示。请回答下列问题:
yC(g) ΔH<0,一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如图所示。请回答下列问题:

(1)用A的浓度变化表示该反应在0~10 min内的平均反应速率v(A)=______________________。
(2)根据图示可确定x∶y=________。
(3)0~10 min容器内压强________(填“变大”、“不变”或“变小”)。
(4)推测第10 min引起曲线变化的反应条件可能是______________________;第16min引起曲线变化的反应条件可能是________________________。
①减压 ②增大A的浓度 ③增大C的量 ④升温⑤降温 ⑥加催化剂
(5)若平衡Ⅰ的平衡常数为K1,平衡Ⅱ平衡常数为K2,则K1________K2(填“>”、“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氧化铬(CrO3)常用于金属镀铬。工业上制造三氧化铬的化学方程式为:X+H2SO4=2CrO3+Na2SO4+H2O,其中X的化学式是
A. Na2CrO4 B. Na2Cr2O7 C. Na2Cr2O4 D. Na2CrO7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A. 1.8 g D2O含有NA个中子
B. 标准状况下,22.4 L己烷中共价键数目为19NA
C. 5.35 g NH4Cl固体中含有N—H键的个数为0.4NA
D. 常温下将0.1 mol Fe投入足量的浓硝酸中,转移的电子数为0.3NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com