
(14分)工业上用铝土矿(主要成分为Al2O3,Fe2O3等)提取Al2O3作冶炼铝的原料,由熔盐电解法获得的粗铝中含一定量的金属钠和氢气,这些杂质可采用吹气精炼法除去,产生的尾气经处理后可用于钢材镀铝。工艺流程如下图所示:
(已知:NaCl熔点为801℃;AlCl3在181℃升华)
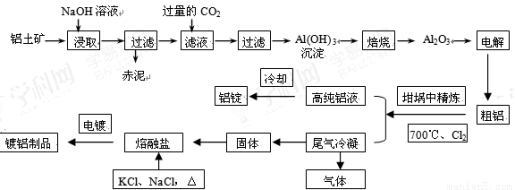
(1)赤泥中的主要成分是 (化学式);向滤液中通入过量CO2所发生反应的离子方程式为 。
(2)精炼前,需清除坩埚表面的氧化铁和石英砂,防止精炼时它们分别与铝发生置换反应产生新的杂质,则铝和氧化铁反应的化学方程式为 。
(3)将Cl2连续通入坩埚中的粗铝熔体,杂质随气泡上浮而除去。气泡的主要成分除Cl2外还含有______。固态杂质粘附于气泡上,在熔体表面形成浮渣,浮渣中肯定存在________。
(4)镀铝电解池中,金属铝为阳极,熔融盐电镀液中铝元素主要以AlCl4-形式存在,则阳极的电极反应式为_____________。
(5)钢材镀铝后,抗腐蚀性能会大大增强,其原因是_____________。
(1)Fe2O3 ; AlO2—+2H2O+CO2=Al(OH)3↓+HCO3—
(2)Fe2O3+2Al 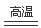 Al2O3+2Fe;(3)HCl和AlCl3;NaCl ;(4)Al-3e-+4Cl-= AlCl4-
Al2O3+2Fe;(3)HCl和AlCl3;NaCl ;(4)Al-3e-+4Cl-= AlCl4-
(5)表面形成的致密氧化铝膜能防止钢材腐蚀或致密的氧化铝膜将环境中的电解质溶液与内层金属隔离
【解析】
试题分析:(1)铝土矿的主要成分为Al2O3,Fe2O3,当向其中加入NaOH溶液时Al2O3发生反应Al2O3+2NaOH=2NaAlO2+2H2O;产生可溶性的物质,而Fe2O3不能在水中溶解,沉在容器的底部,成为阳极泥。所以赤泥中的主要成分是Fe2O3;向滤液中通入过量CO2所发生反应的离子方程式是AlO2—+2H2O+CO2=Al(OH)3↓+HCO3—;(2)铝和氧化铁在高温下发生铝热反应,反应的化学方程式为Fe2O3+2Al  Al2O3+2Fe;(3)将Cl2连续通入坩埚中的粗铝熔体,杂质随气泡上浮而除去。当通入氯气时,气泡的主要成分除Cl2外还含有Al与Cl2反应产生的AlCl3及表面水分反应产生的HCl。固态杂质粘附于气泡上,在熔体表面形成浮渣,由于Al2O3是从NaOH溶液中过滤出来的,表面有NaOH杂质,当通入Cl2是发生反应产生NaCl,所以浮渣中肯定存在NaCl。(4)镀铝电解池中,金属铝为阳极,熔融盐电镀液中铝元素主要以AlCl4-形式存在,则阳极发生氧化反应,该电极的电极反应式为Al-3e-+4Cl-= AlCl4-;(5)钢材镀铝后,抗腐蚀性能会大大增强,其原因是表面形成的致密氧化铝膜能防止钢材腐蚀或致密的氧化铝膜将环境中的电解质溶液与内层金属隔离。
Al2O3+2Fe;(3)将Cl2连续通入坩埚中的粗铝熔体,杂质随气泡上浮而除去。当通入氯气时,气泡的主要成分除Cl2外还含有Al与Cl2反应产生的AlCl3及表面水分反应产生的HCl。固态杂质粘附于气泡上,在熔体表面形成浮渣,由于Al2O3是从NaOH溶液中过滤出来的,表面有NaOH杂质,当通入Cl2是发生反应产生NaCl,所以浮渣中肯定存在NaCl。(4)镀铝电解池中,金属铝为阳极,熔融盐电镀液中铝元素主要以AlCl4-形式存在,则阳极发生氧化反应,该电极的电极反应式为Al-3e-+4Cl-= AlCl4-;(5)钢材镀铝后,抗腐蚀性能会大大增强,其原因是表面形成的致密氧化铝膜能防止钢材腐蚀或致密的氧化铝膜将环境中的电解质溶液与内层金属隔离。
考点:考查电解反应原理的应用、铝热反应、铝元素的电子及化合物的性质、金属的腐蚀与保护的知识。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2015届河南郑州市高三上第一次(10月)月考化学试卷(解析版) 题型:选择题
某气体的摩尔质量为M g·mol-1,NA表示阿伏加德罗常数,在一定的温度和压强下,体积为V L的该气体所含有的分子数为x。则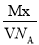 表示的是( )
表示的是( )
A.V L该气体的质量(以g为单位)
B.1 L该气体的质量(以g为单位)
C.1 mol该气体的体积(以L为单位)
D.1 L该气体中所含的分子数
查看答案和解析>>
科目:高中化学 来源:2015届河南省洛阳市高三上学期期中考试化学试卷(解析版) 题型:选择题
下列叙述不正确的是
A.将SO2通入BaCl2溶液中至饱和,无沉淀产生;再通入Cl2产生沉淀
B.向AlCl3溶液中加氨水,产生白色沉淀;再加入过量氨水,沉淀消失
C.在稀硫酸中加入铜粉,铜粉不溶解;再加入Cu(NO3)2固体,铜粉溶解
D.纯锌与稀硫酸反应产生氢气的速率较慢:再加入少量CuSO4固体,速率加快
查看答案和解析>>
科目:高中化学 来源:2015届河南省高三9月第二次阶段考化学试卷(解析版) 题型:选择题
符合前者条件的溶液中一定可以大量共存的离子组是 ( )
A.既能溶解Al(OH)3,又能溶解H2SiO3的溶液:Na+、Fe2+、SO42-、Cl-
B.能使酚酞溶液变红的溶液:Na+、NO3-、S2-、Br -
C.投入铁片能产生H2的无色溶液:H+、Mg2+、SO42-、NO3-
D.含有大量Fe3+的溶液:Na+、Al3+、NO3-、SCN-
查看答案和解析>>
科目:高中化学 来源:2015届河南省高三9月第二次阶段考化学试卷(解析版) 题型:选择题
下列情况不能用胶体知识加以解释的是 ( )
A.氯化铝溶液中加入小苏打溶液会产生白色沉淀和无色气体
B.肾功能衰竭等疾病引起的血液中毒,可利用血液透析进行治疗
C.水泥厂、冶金厂常用高压电除工厂烟尘,以减少对空气的污染
D.牛油与烧碱溶液共热,向反应所得溶液中加入食盐,则有固体析出
查看答案和解析>>
科目:高中化学 来源:2014-2015学年陕西省高三上学期期中理综化学试卷(A)(解析版) 题型:选择题
设NA为阿伏加德罗常数的值,下列有关叙述正确的是
A.0.1mol NH3溶于足量水中(不考虑氨气挥发),溶液中N原子的数目为0.1NA
B.标准状况下,22.4LNO与CO2的混合气体中含有O原子数为3NA
C.0.1molN2与足量的H2反应,转移的电子数是0.6NA
D.58.5 g的NaCl固体中含有NA个氯化钠分子
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省天水市高三上学期第四次检测化学试卷(解析版) 题型:填空题
(10分)蛇纹石可用于生产氢氧化镁,简要工程如下:
Ⅰ.制取粗硫酸镁:用酸液浸泡蛇纹石矿粉,过滤,并在常温常压下结晶,制得粗硫酸镁(其中常含有少量Fe3+、Al3+、Fe2+等杂质离子)
Ⅱ.提纯粗硫酸镁,将粗硫酸镁在酸性条件下溶解,加入适量的0.1mol/LH2O2溶液,再调节溶液pH至7~8,并分离提纯。
Ⅲ.制取氢氧化镁,向步骤II所得溶液中加入过量氨水。
已知:金属离子氢氧化物沉淀所需pH
Fe3+ | Al3+ | Fe2+ | Mg2+ | |
开始沉淀时 | 1.5 | 3.3 | 6.5 | 9.4 |
沉淀完全时 | 3.7 | 5.2 | 9.7 | 12.4 |
请回答:
(1)步骤II中加入适量的0.1mol/LH2O2溶液的目的是 ;可用于调节溶液pH至7~8的最佳试剂是 (填字母序号)
A.MgO B.Na2CO3 C.蒸馏水 D.NaOH .
(2)工业上常以Mg2+的转化率为考查指标,确定步骤III制备氢氧化镁工艺过程的适宜条件。
其中,反应温度与Mg2+转化率的关系如图所示。
①步骤III中制备氢氧化镁反应的离子方程式为 。根据图中所示50℃前温度与Mg2+转化率之间的关系,可判断此反应是 (填“吸热”或“放热”反应)

②图中,温度升高至50℃以上Mg2+转化率下降的可能原因是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省天水市高三上学期第四次检测化学试卷(解析版) 题型:选择题
实验用含有杂质(FeO、Fe2O3)的废CuO制备胆矾晶体,经历下列过程,
已知Fe3+在pH=5时已完全沉淀,其中分析错误的是

A.利用CuCO3替代CuO也可调节溶液的pH,不影响实验结果
B.步骤②中发生的主要反应为:H2O2+2Fe2++2H+=2Fe3++2H2O
C.洗涤:向装晶体的漏斗中加水至浸没晶体,待自然流下后重复2~3次
D.某实验需要240 mL1mol/L的CuSO4溶液,则配制时需称量CuSO4·5H2O 60g
查看答案和解析>>
科目:高中化学 来源:2014-2015河南省英文学校高一上学期12月月考化学试卷(解析版) 题型:选择题
把铁片分别放入下列溶液中,铁片溶解,而溶液质量增加,但无气体产生,此溶液是
A.稀硫酸 B.AgNO3溶液
C.Fe2(SO4)3溶液 D.CuSO4溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com