
分析 (1)碳酸钠是强碱弱酸盐,其溶液呈碱性;
(2)碳酸根离子水解导致溶液中氢氧根离子浓度大于氢离子浓度;
(3)a.完全电离的电解质是强电解质;
b.根据碳酸钠溶液中的物料守恒分析;
c.钠离子不水解,碳酸根离子水解导致溶液呈碱性,但水解程度较小;
(4)用石墨作电极电解Na2CO3溶液时,阴极上氢离子放电生成氢气.
解答 解:(1)碳酸钠是强碱弱酸盐,碳酸根离子水解导致其溶液呈碱性,pH>7,
故答案为:<;
(2)碳酸根离子水解导致溶液中氢氧根离子浓度大于氢离子浓度,水解方程式为:CO32-+H2O?OH-+HCO3-,故答案为:CO32-+H2O?OH-+HCO3-;
(3)a.Na2CO3在水溶液完全电离,属于强电解质,故a正确;
b.根据碳酸钠溶液中的物料守恒可得:c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)=0.1mol/L,故b正确;
c.钠离子不水解,碳酸根离子水解生成氢氧根离子和碳酸氢根离子,碳酸氢根离子水解生成碳酸和氢氧根离子,所以该溶液中离子浓度大小关系为:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+),故c正确;
故答案为:abc;
(4)用石墨作电极电解Na2CO3溶液时,阴极上氢离子放电生成氢气,电极反应式为:2H++2e-=H2↑,故答案为:2H++2e-=H2↑.
点评 本题考查了离子浓度大小比较,题目难度中等,涉及盐类水解、电解池原理及离子浓度大小比较,根据盐的性质确定弱离子的水解,根据溶液酸碱性结合电荷守恒确定离子浓度大小,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:解答题
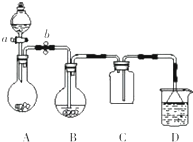 某化学小组设计了如图所示装置.用以探究Cu跟浓H2SO4的反应并收集少量气态产物(加热及夹持装置省略).
某化学小组设计了如图所示装置.用以探究Cu跟浓H2SO4的反应并收集少量气态产物(加热及夹持装置省略).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲醇[CH3OH] | B. | 氯化钙[CaCl2] | C. | 尿素[CO(NH2)2] | D. | 亚硝酸钠[NaNO2] |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A.用Ca(OH)2和 NH4Cl制取NH3 | B.从碘水中提取碘单质 | C.从食盐水中获取氯化钠 | D.用自来水制取蒸馏水 |
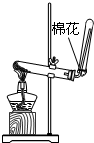 | 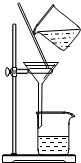 | 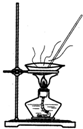 |  |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
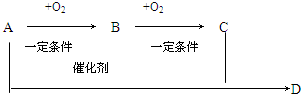 根据如图有机物的转化关系回答.已知A是乙醇.
根据如图有机物的转化关系回答.已知A是乙醇.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 (“→”表示一步完成)关系相互转化的是( )
(“→”表示一步完成)关系相互转化的是( )| 选项 | a | b | c |
| A | Fe | FeCl3 | FeCl2 |
| B | MgO | MgCl2 | Mg(OH)2 |
| C | Si | SiO2 | H2SiO3 |
| D | NaOH | Na2CO3 | Na2SO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2KMnO4+5H2${\;}_{\;}^{18}$O2+3H2SO4→K2SO4+2MnSO4+5${\;}_{\;}^{18}$O2↑+8H2O | |
| B. | NH4Cl+${\;}_{\;}^{2}$H2O?NH3•${\;}_{\;}^{2}$H2O+HCl | |
| C. | K${\;}_{\;}^{37}$ClO3+6HCl→K${\;}_{\;}^{37}$Cl+3Cl2↑+3H2O | |
| D. | 2Na2O2+2H2${\;}_{\;}^{18}$O→4NaOH+${\;}_{\;}^{18}$O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有离子键 | B. | 属于原子晶体 | ||
| C. | 既有离子键又有共价键 | D. | 属于离子晶体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com