
(10分)
(1)Cu(NO3)2的水溶液呈 (填“酸”、“中”、“碱”)性,常温时的pH 7(填“>”、“=”、“<”),原因是(用离子方程式表示): ;实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以 (填“促进”、“抑制”)其水解。
(2)氯化铝水溶液呈 性,原因是(用离子方程式表示):______ ,把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是 。
(3)在配制硫化钠溶液时,为了防止发生水解,可以加入少量的 。
(10分)(1) 酸,<,Cu2++ H2O 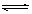 Cu(OH)2+ 2H+,抑制
Cu(OH)2+ 2H+,抑制
(2)酸,Al3++3H2O 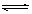 Al(OH)3+3H+, Al2O3 (3)NaOH
Al(OH)3+3H+, Al2O3 (3)NaOH
解析试题分析:(1)Cu(NO3)2是强酸弱碱盐,铜离子水解,水溶液呈酸性,pH小于7。水解方程式是Cu2++ H2O 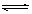 Cu(OH)2+ 2H+;硝酸银溶于水,银离子水解,溶液显酸性。所以将AgNO3固体先溶于较浓的硝酸中的目的是抑制银离子的水解。
Cu(OH)2+ 2H+;硝酸银溶于水,银离子水解,溶液显酸性。所以将AgNO3固体先溶于较浓的硝酸中的目的是抑制银离子的水解。
(2)氯化铝溶于水,铝离子水解,溶液显酸性,水解方程式是Al3++3H2O 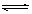 Al(OH)3+3H+。水解吸热,加热促进水解,且生成的氯化氢挥发,进一步促进水解,所以最终得到的是氢氧化铝,灼烧得到氧化铝。
Al(OH)3+3H+。水解吸热,加热促进水解,且生成的氯化氢挥发,进一步促进水解,所以最终得到的是氢氧化铝,灼烧得到氧化铝。
(3)硫化钠溶于水,硫离子水解,溶液显碱性。所以在配制硫化钠溶液时,为了防止发生水解,可以加入少量的氢氧化钠。
考点;考查盐类水解的应用
点评:盐电离出来的离子结合水电离出来的 H+或 OH-生成弱电解质的过程。盐类水解的应用主要有:①判断盐溶液的酸碱性和比较盐溶液酸碱性的强弱时,通常需考虑盐的水解。②比较盐溶液中各离子浓度的相对大小时,当盐中含有易水解的离子,需考虑盐的水解。③判断溶液中离子能否大量共存。当有弱碱阳离子和弱酸阴离子之间能发生强烈双水解,则不能在溶液中大量共存。④配制易水解的盐溶液时,需考虑抑制盐的水解。⑤选择制备盐的途径时,需考虑盐的水解。⑥离子除杂、化肥的使用需考虑盐类的水解。⑦溶液中离子浓度大小比较时需要考虑盐类水解。


 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案科目:高中化学 来源: 题型:
常温下,在27.9g水中溶解12.1 g Cu(NO3)2·3H2O,恰好达到饱和。设该溶液密度为1.20g /cm3。求:
(1)溶质的质量分数;
(2)该溶液中NO3—的物质的量浓度;
(3)常温下,Cu(NO3)2的溶解度;
(4)将一根质量为100g的铁棒插入到该溶液中,一段时间后取出,洗净、干燥后称量,铁棒的质量变为100.2g,求此时溶液中Fe(NO3)2的物质的量浓度。(忽略溶液体积的变化)
查看答案和解析>>
科目:高中化学 来源:2010年北京育园中学高二上学期分班考试化学试题 题型:填空题
(4分)铜跟浓硝酸可发生反应:
Cu + 4HNO3(浓) =" " Cu(NO3)2 + 2NO2 +2H2O
在该反应中,铜元素的化合价 (填“升高”或“降低”),被 (填“氧化”或“还原”,下同);Cu作 剂若反应中生成了1 mol Cu(NO3)2,则消耗了 mol Cu。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年福建省泉州市高三质检理综化学试卷(解析版) 题型:填空题
无水硝酸铜极易吸水,加热到210℃升华,它和Cu(NO3)2 ·3H2O晶体的化学性质有较大差异, Cu(NO3)2 ·3H2O晶体加热到170℃分解。已知:乙酸乙酯的沸点为77 ℃。
(1)加热蒸干Cu(NO3)2 溶液得不到无水硝酸铜的原因是_____________。
(2)将铜片加人到N2 O 4的乙酸乙酯溶液中可制得无水硝酸铜,同时生成NO,写出反应的化学方程式_____________;从乙酸乙醋中分离出无水硝酸铜的实验操作是_____________。
(3)为探究Cu(NO3)2 ·3H2O受热分解的产物,某探究小组利用下图装置进行实验。(图中夹持和加热装置去)

往试管A中加人研细的Cu(NO3)2 ·3H2O体并加热,观察到试管A中有红棕色气生成,最终残留黑色粉末;U型管中有液体生成,在试管B中收集到无色气体。
①当导管口不再有气池冒出时,反应停止,拆除装置的操作首先是______。
②试管B中收集到的气体一定含有______。
(4)锌与Cu(NO3)2溶液能发生反应。在一支试管中注人1 mol·L-1的Cu(NO3)2溶液,再放入一块锌片,观察到在反应初期有大量无色气泡冒出,同时锌片上析出红色固体。该小组猜想气体的成分,并设计的实验步骤,请填写下表。

查看答案和解析>>
科目:高中化学 来源:2014届辽宁省分校高二12月月考化学试卷(解析版) 题型:填空题
(10分)
(1)Cu(NO3)2的水溶液呈 (填“酸”、“中”、“碱”)性,常温时的pH 7(填“>”、“=”、“<”),原因是(用离子方程式表示): ;实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以 (填“促进”、“抑制”)其水解。
(2)氯化铝水溶液呈 性 ,原因是(用离子方程式表示):______ ,把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是 。
(3)在配制硫化钠溶液时,为了防止发生水解,可以加入少量的 。
查看答案和解析>>
科目:高中化学 来源:2010年四川省高一上学期期中考试化学试卷 题型:计算题
常温下,在27.9g水中溶解12.1 g Cu(NO3)2·3H2O,恰好达到饱和。设该溶液密度为1.20g /cm3。求:
(1)溶质的质量分数;(3分)
(2)该溶液中NO3—的物质的量浓度;(3分)
(3)常温下,Cu(NO3)2的溶解度;(4分)
(4)将一根质量为100g的铁棒插入到该溶液中,一段时间后取出,洗净、干燥后称量,铁棒的质量变为100.2g,求此时溶液中Fe(NO3)2的物质的量浓度。(忽略溶液体积的变化)(4分)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com