
【题目】用98%的浓H2SO4(ρ=1.84g/ml)配制 1mol/L的稀硫酸100mL,按配制溶液时仪器的选用顺序排列,选择正确的是( )
① 玻璃棒 ② 胶头滴管 ③ 100mL容量瓶 ④ 托盘天平 ⑤ 50mL烧杯 ⑥10mL量筒
⑦ 100mL量筒 ⑧ 移液管 ⑨ 滴定管
A.⑥③⑧⑤①② B.⑥⑤③①⑨② C.④⑤③②①⑨ D.⑥⑤①③②
科目:高中化学 来源: 题型:
【题目】糖类、油脂和蛋白质是维持人体生命活动的三大营养物质。下列有关说法正确的是 ( )
A.三大营养物质均属于天然高分子化合物
B.食用的蛋白质、糖和油脂都可发生水解反应
C.用于纺织的棉花和蚕丝的主要成分都是纤维素
D.75%酒精可用于杀死新型冠状病毒是因为酒精使蛋白质变性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】手持技术的氧电化学传感器可用于测定O2含量.下图为某种氧电化学传感器的原理示意图,已知在测定O2含量过程中,电解质溶液的质量保持不变。一定时间内,若通过传感器的待测气体为a L(标准准状况),某电极增重了bg。下列说法正确的是
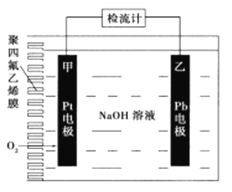
A. Pt上发生氧化反应 B. Pb上的电极反应式为4OH--4e-=O2↑+2H2O
C. 反应过程中转移OH-的物质的量为0.25bmol D. 待测气体中氧气的体积分数为0.7b/a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合氯化铝是一种新型净水剂,其中铝的总浓度(用c表示)包括三类:主要为Al3+中的单体形态铝(用Ala表示)总浓度,主要为 [AlO4Al12(OH)24(H2O)12]7+的中等聚合形态铝总浓度(用Alb表示)和Al(OH)3胶体形态铝(用Alc表示)总浓度。
(1)真空碳热还原一氧化法可实现由铝土矿制备金属铝,相关反应的热化学方程式如下:
①Al2O3(s)+AlCl3(g)+3C(s)=3AlCl(g)+3CO(g) ΔH1=akJ·mol-1
②6AlCl(g)=4Al(s)+2AlCl3(g) ΔH2=bkJ·mol-1
则反应Al2O3(s) +3C(s)=2Al (s)+3CO(g) 说明ΔH=_______kJ·mol-1(用含a、b的代数式表示)。
_0( 填“>”或“<”)。
反应①在常压、1900℃的高温下才能进行,说明ΔH_______0(填“>”、“<”或“=”)
(2)用膜蒸馏(简称MD)浓缩技术将聚合氯化铝溶液进行浓缩,实验过程中不同浓度聚合氯化铝溶液中铝形态分布(百分数)如右表:
AlT/(mol·L-1) | Ala/% | Alb/% | A1c/% |
0.208 | 1.4 | 86.6 | 12.0 |
0.489 | 2.3 | 86.2 | 11.5 |
0.884 | 2.3 | 88.1 | 9.6 |
1.613 | 3.1 | 87.0 | 9.9 |
2.520 | 4.5 | 88.2 | 7.3 |
①在一定温度下,AlT越大,Al(OH)3胶体的百分含量________(填“越大”“越小”或“不变”)。
②若将c=2.520mol/L的聚合氧化铝溶液加水稀释,则稀释过程中发生的主要反应的离子方程式为_________________________________。
(3)一定条件下,向1.0mol/L的AlCl溶液中加入0.6mol/L的NaOH溶液,可制得Alb含量约为86% 的聚合氯化铝溶液。写出生成[AlO4Al12(OH)24(H2O)12]7+的离子方程式:_________________________。
(4)已知Al3++4X![]() 2
2![]() ,X表示显色剂,
,X表示显色剂,![]() 表示有色物质,通过比色分析得
表示有色物质,通过比色分析得
到25 ℃时Al3+浓度随时间的变化关系如图所示(初始时X的浓度为0.194 mol·L-1)。
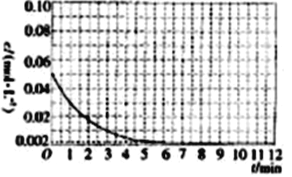
①1min时, ![]() 的浓度为___________。
的浓度为___________。
②0~3min内该反应的速率vx=________。
③第9min时,反应达到平衡,K=__________(用代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 钡中毒患者可尽快使用苏打溶液洗胃,随即导泻使Ba2+转化为BaCO3而排出
B. 工业上可以用NaHS、(NH4)2S等可溶性硫化物作沉淀剂除去废水中的Hg2+
C. 水中的Mg(HCO3)2、Ca(HCO3)2受热易分解生成难溶性的MgCO3、CaCO3,故水垢的主要成分是MgCO3、CaCO3
D. 珊瑚虫从周围海水中获取Ca2+和![]() ,经反应形成石灰石(CaCO3)外壳,从而逐渐形成珊瑚
,经反应形成石灰石(CaCO3)外壳,从而逐渐形成珊瑚
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常用3.7 mol/L的硫酸与锌粒制取氢气,要加快该反应的速率,采取措施错误的是
A.加入2 mol/L的硫酸B.加入少量CuSO4
C.适当加热D.加入NaHSO4固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷化铜(Cu3P2)用于制造磷青铜,磷青铜是含少量锡、磷的铜合金,主要用作耐磨零件和弹性原件。
(1)基态铜原子的电子排布式为______;价电子中成对电子数有____个。
(2)磷化铜与水作用产生有毒的磷化氢(PH3)。
①PH3分子中的中心原子的杂化方式是_________。
②P与N同主族,其最高价氧化物对应水化物的酸性:HNO3___H3PO4(填“>”或“<”),从结构的角度说明理由:__________________________。
(3)磷青铜中的锡、磷两元素电负性的大小为Sn___P(填“>”“<”或“=”)。
(4)某磷青铜晶胞结构如图所示。
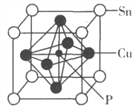
①则其化学式为________。
②该晶体中距离Cu原子最近的Sn原子有______个,这些Sn原子所呈现的构型为_________。
③若晶体密度为8.82g·cm-3,最近的Cu原子核间距为____pm(用含NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某浅绿色晶体X[x(NH4)2SO4·yFeSO4·zH2O]在分析化学中常用作还原剂. 为确定其组成,某小组同学进行如下实验.
I.NH4+的测定
采用蒸馏法,蒸馏装置如图所示。
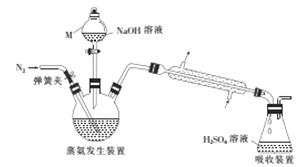
相关的实验步骤如下:
①准确称取58.80g晶体X,加水溶解后,将溶液注入三颈烧瓶中;
②准确量取50.00mL3.0300molL-1H2SO4溶液于锥形瓶中;
③向三颈烧瓶中加入足量NaOH溶液,通入氮气,加热,蒸氨结束后取下锥形瓶;
④用0.120molL-1NaOH标准溶液滴定锥形瓶中过量的硫酸,滴定终点时消耗25.00mL NaOH标准溶液.
(1)仪器M的名称为__________。
(2)步骤③中,发生的氧化还原反应的化学方程式为____________。蒸氨结束后,为了减少实验误差,还需要对直形冷凝管进行“处理”,“处理”的操作方法是_____________。
(3)步骤④中,若振荡时锥形瓶中有液体溅出,则所测得的n(NH4+)的值将______(填“偏大”“偏小”或“不变”)。
II.SO42-含量的测定
采用重量分析法,实验步骤如下:
①另准确称取58.80g晶体X 于烧杯中,加水溶解,边搅拌边加入过量的BaCl2溶液;
②将得到的溶液用无灰滤纸(灰分质量很小,可忽略)过滤,洗涤沉淀3~4次;
③用滤纸包裹好沉淀取出,灼烧滤纸包至滤纸完全灰化;
④继续灼烧沉淀至恒重、称量,得沉淀质量为69.90g。
(4)步骤①中,判断BeCl 溶液已过量的实验操作和现象是___________。
(5)步骤②中,采用冷水洗讓沉淀,其主要目的是___________。
(6)结合实验Ⅰ、Ⅱ通过计算得出晶体X的化学式为__________。实验I 的步骤①中,溶液中离子溶度由大到小的顺序为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列说法正确的是( )
A.常温常压下,23g NO2含有NA个氧原子
B.标准状况下,22.4L H2O含有NA个H2O分子
C.含10 NA个电子的N2分子的物质的量是1mol
D.0.1mol/L的Ba(OH)2溶液中,OH﹣的个数为0.2NA个
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com