
【题目】碳、及其化合物在生产中有重要应用。
(1)设反应 ① Fe(s) + CO2(g)![]() FeO(s) + CO(g) ⊿H = Q1 平衡常数为K1
FeO(s) + CO(g) ⊿H = Q1 平衡常数为K1
② Fe(s) + H2O(g)![]() FeO(s) + H2(g) ⊿H = Q2 平衡常数为K2
FeO(s) + H2(g) ⊿H = Q2 平衡常数为K2
不同温度下,K1、K2的值如下表
T/K | K1 | K2 |
973 | 1.47 | 2.38 |
1173 | 2.15 | 1.67 |
现有反应 ③ H2(g) + CO2(g)![]() CO(g) + H2O(g) ⊿H = Q3,结合上表数据,根据反应①、②推导出Q1、Q2、Q3的关系式Q3=_____________,反应③是________(填“放”或“吸”)热反应。
CO(g) + H2O(g) ⊿H = Q3,结合上表数据,根据反应①、②推导出Q1、Q2、Q3的关系式Q3=_____________,反应③是________(填“放”或“吸”)热反应。
(2)已知CO2催化加氢合成乙醇的反应原理为:2CO2(g)+6H2(g)![]() C2H5OH(g)+3H2O(g) ⊿H <0
C2H5OH(g)+3H2O(g) ⊿H <0
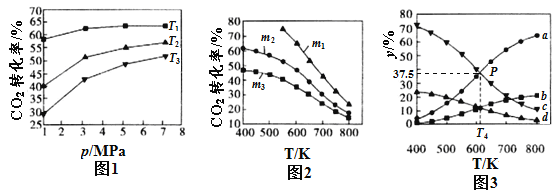
①图l、图2分别是CO2的平衡转化率随压强及温度的变化关系,已知m为起始时的投料比,即m=n(H2)/n(CO2),图l中投料比相同,温度从高到低的顺序为________,图2中m1、m2、m3从大到小的顺序为_____________。
②图3表示在总压为5MPa的恒压条件下,且m=3时,平衡状态时各物质的物质的量分数与温度的关系。则曲线d代表的物质为________(填化学式),T4温度时,该反应的平衡常数Kp=________。(提示:用平衡分压代替平衡浓度来计算,某组分平衡分压=总压×该组分的物质的量分数,结果保留小数点后三位)
【答案】 Q3 = Q1-Q2 吸热 T3>T2>T1 m1>m2>m3 C2H5OH 0.250
【解析】试题分析:(1)根据盖斯定律计算Q3;K1=![]() ,K2=
,K2=![]() ;K3=
;K3=![]() ,分别计算973K、1173K时K3的平衡常数,根据平衡常数变化判断吸放热;(2)①正反应放热,温度越高CO2的平衡转化率越小;增大n(H2),平衡正向移动,CO2的平衡转化率越大;②升高温度平衡逆向移动,CO2、H2含量增大、C2H5OH、H2O减小,乙醇的含量是水蒸气的
,分别计算973K、1173K时K3的平衡常数,根据平衡常数变化判断吸放热;(2)①正反应放热,温度越高CO2的平衡转化率越小;增大n(H2),平衡正向移动,CO2的平衡转化率越大;②升高温度平衡逆向移动,CO2、H2含量增大、C2H5OH、H2O减小,乙醇的含量是水蒸气的![]() 倍;根据K=
倍;根据K=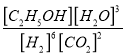 计算;
计算;
解析:(1)①Fe(s)+CO2(g)![]() FeO(s)+CO(g) △H=Q1;
FeO(s)+CO(g) △H=Q1;
②Fe(s)+H2O(g)![]() FeO(s)+H2(g) △H=Q2;根据盖斯定律①-②得H2(g)+CO2(g)
FeO(s)+H2(g) △H=Q2;根据盖斯定律①-②得H2(g)+CO2(g)![]() CO(g)+H2O(g) △H=Q3= Q1-Q2;K1=
CO(g)+H2O(g) △H=Q3= Q1-Q2;K1=![]() ,K2=
,K2=![]() ;K3=
;K3=![]() ,所以973K时K3=0.62、1173K时K3=1.29,升高温度平衡常数增大,所以正反应吸热;(2)①正反应放热,温度越高CO2的平衡转化率越小,所以温度从高到低的顺序为T3>T2>T1;增大n(H2),平衡正向移动,CO2的平衡转化率越大,所以m1、m2、m3从大到小的顺序为m1>m2>m3;②升高温度平衡逆向移动,CO2、H2含量增大、C2H5OH、H2O减小,乙醇的含量是水蒸气的
,所以973K时K3=0.62、1173K时K3=1.29,升高温度平衡常数增大,所以正反应吸热;(2)①正反应放热,温度越高CO2的平衡转化率越小,所以温度从高到低的顺序为T3>T2>T1;增大n(H2),平衡正向移动,CO2的平衡转化率越大,所以m1、m2、m3从大到小的顺序为m1>m2>m3;②升高温度平衡逆向移动,CO2、H2含量增大、C2H5OH、H2O减小,乙醇的含量是水蒸气的![]() 倍,所以曲线d代表的物质为C2H5OH;Kp
倍,所以曲线d代表的物质为C2H5OH;Kp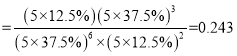 ;
;


科目:高中化学 来源: 题型:
【题目】元素铬及其化合物工业用途广泛,但含+6价铬的污水会损害环境,必须进行处理。某工厂的处理工艺流程如下:
![]()
(1)N2H4的电子式为___________。
(2)下列溶液中,可以代替上述流程中N2H4的是___________。(填选项序号)
A.FeSO4溶液 B.浓HNO3溶液 C.酸性KMnO4溶液 D.Na2SO3溶液
(3)已知加入N2H4的流程中,N2H4转化为无污染的物质,则该反应中氧化剂与还原剂的物质的量之比为___________。
(4)在实际的含铬废水处理中,还可采用直接沉淀的方法,处理成本较低。
①已知含铬酸性废水中存在着Cr2O72-和CrO42-相互转化的平衡,请用离子方程式表示它们之间的转化反应___________;
②在实际工业生产中,加入沉淀剂BaCl2溶液之前还要加入一定量的NaOH,这样有利于沉淀的生成,则生成的沉淀为____________写化学式)。
(5)工业上可用电解法来处理含Cr2O![]() 的酸性废水。具体方法是首先通过电解制得还原剂,然后还原剂将Cr2O
的酸性废水。具体方法是首先通过电解制得还原剂,然后还原剂将Cr2O![]() 还原为Cr3+,最终转化成Cr(OH)3沉淀而除去。如图为电解装置示意图(电极材料分别为铁和石墨)。
还原为Cr3+,最终转化成Cr(OH)3沉淀而除去。如图为电解装置示意图(电极材料分别为铁和石墨)。

①装置中b电极的材料是________(填“铁”或“石墨”)。
②上述处理过程中,Cr2O![]() 被还原成Cr3+的离子方程式为_______________________。
被还原成Cr3+的离子方程式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.1molCl2和足量的铁加热条件下反应,转移电子数一定为3NA
B.常温常压下,8.8g CO2和N2O的混合气体所含电子数为4.4 NA
C.常温下,PH=13的Ba(OH)2 溶液,0.1L,含OH﹣ , 0.02NA
D.1 L 1 mol/L的乙醇水溶液中含有氢原子总数为6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】直接排放含SO2会形成酸雨,危害环境。某化学实验小组用如下装置进行有关SO2性质的探究活动。
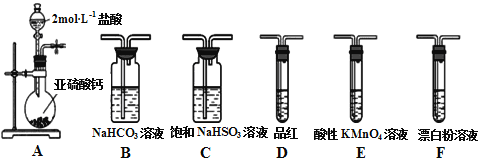
(1)装置A中反应的离子方程式为___________________________________。
(2)选用以上装置和药品探究亚硫酸与次氯酸的酸性强弱:甲同学认为按照A→C→F→尾气处理顺序连接装置可以证明,乙同学认为该方案不合理,其理由是___________________。正确的连接顺序是:A→C→___________→尾气处理(填字母)顺序连接装置。证明亚硫酸的酸性强于次氯酸的酸性的实验现象是__________________________。
(3)将二氧化硫通入以下装置可以制备Na2S2O3:

①装置B的作用是检验装置A中SO2的吸收效率,B中试剂是________________。
②写出装置A中发生反应的化学方程式___________________________________。
③Na2S2O3溶液是定量实验中的常用试剂,测定其浓度的过程如下:
第一步:准确称取a g KIO3(化学式量:214)固体配成溶液;
第二步:加入过量KI固体和H2SO4溶液,滴加指示剂;
第三步:用Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液的体积为V mL。则c(Na2S2O3)=____mol·L-1。(已知:IO3-+5I-+6H+= 3I2+3H2O, 2S2O32-+I2=S4O62-+2I-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知室温下乙醛的沸点为20.8℃,且与水互溶.用HgSO4做催化剂,在75℃左右,乙炔可水化为乙醛,但HgSO4遇到某些特定物质常会发生催化剂中毒而失去催化作用,H2S就是其中一种:现用乙炔水化法,只用块状电石、浓硫酸、水、NaOH溶液、HgO粉末五种物质制取乙醛,装置如图所示,请回答下列问题; 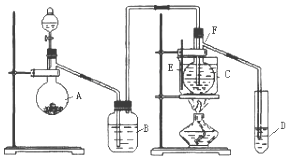
(1)实验开始时,仪器A中盛放电石,B中装NaOH溶液,其作用是 .
(2)仪器D中盛放水,其作用是吸收蒸气.
(3)蒸馏烧瓶F中应加入HgO和浓硫酸、水两种试剂,若将三者分别直接加入,请按加入的先后顺序写出包括HgO在内的各试剂的名称:氧化汞→→ .
(4)装置图中,加热F的方法叫 , 所选用温度计F的量程表示正确的是(填代号). A.0℃~50℃B.0℃~100℃C.0℃~200℃D. 0℃~360℃
(5)检验乙醛已制出的操作及现象是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香化合物M的结构简式为 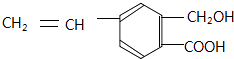 ,关于有机物M的说法正确的是( )
,关于有机物M的说法正确的是( )
A.有机物M中含有四种官能团
B.1 molNa2CO3最多能消耗1 mol有机物M
C.1 mol M和足量金属钠反应生成22.4 L气体
D.有机物M能发生取代、氧化和加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.1molN2中含有的分子数为2×6.02×1023
B.用激光笔照射CuSO4溶液可产生“丁达尔效应”
C.常温下,铝片能溶于浓硫酸
D.常温下,淀粉溶液遇I2变为蓝色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com