
| A. | 碳酸钠 | B. | 醋酸 | C. | 乙醇 | D. | 氯化钠 |
分析 水为弱电解质,能够电解出氢离子和氢氧根离子,在溶液中存在电离平衡;加入酸溶液和碱溶液能够抑制水的电离,加入能够水解的盐促进了水的电离,据此进行判断.
解答 解:A、碳酸钠溶液中碳酸根离子水解溶液显碱性,水的电离程度增大,碳酸钠促进了水的电离,故A正确;
B、加入醋酸,溶液中氢离子浓度增大,水的电离平衡向着逆向移动,抑制了水的电离,故B错误;
C、加入乙醇,乙醇为非电解质,对水的电离平衡不产生影响,故C错误;
D、加入氯化钠,钠离子和氯离子都不影响水的电离,故D错误;
故选A.
点评 本题考查了水的电离及其影响因素,题目难度不大,注意掌握水的电离及影响,明确酸碱溶液抑制水的电离,含有弱酸根或者弱碱根离子的盐能够促进水的电离.


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物 质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| 溶度积/25℃ | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
| 完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | 3~4 |
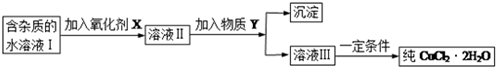
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
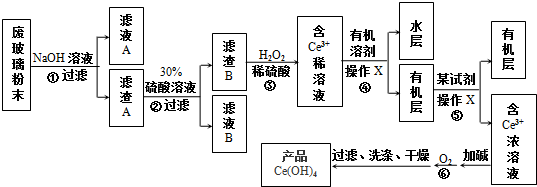
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HF、HCl、HBr、HI的熔点沸点依次升高 | |
| B. | 氯的各种含氧酸的酸性由强到弱排列为HClO4<HClO3<HClO2<HClO | |
| C. | 元素的性质呈现周期性变化的根本原因是元素原子的核外电子排布呈周期性变化 | |
| D. | 稀有气体一般难于发生化学反应,是由于其键能大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 操作现象 |
| i | 取少量固体样品,加入过量稀盐酸,固体溶解,产生气体(经检验为H2),溶液呈浅黄色 |
| ii | 向i所得溶液中加入少量KSCN溶液,溶液呈浅红色,再加入H2O2溶液,产生无色气体(经检验为O2,溶液变为深红色) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2+2H2O→CH4+2O2 | B. | NaOH+HCl=NaCl+H2O | ||
| C. | Cu+2HCl=Cu Cl2+H2↑ | D. | 4Al+3O2+6H2O=4Al(OH)3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com