
| 元素 | 相关信息 |
| A | 基态原子的价电子排布式为nSnnPn |
| B | 基态原子中的未成对电子数是同周期中最多的 |
| C | 最外层电子数是电子层数的3倍 |
| D | 简单离子是第三周期元素中离子半径最小的 |
| E | 价电子层中的未成对电子数为4 |
 .
.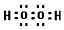 .
. 分析 A、B、C、D、E是元素周期表前四周期中的常见元素,原子序数依次增大,由A的基态原子的价电子排布式可知,n=2,则A为C元素;C的最外层电子数是电子层数的3倍,则C为O元素;B的基态原子中的未成对电子数是同周期中最多的,可知p能级上只有3个电子,结合原子序数可知,B为N元素;D为简单离子是第三周期元素中离子半径最小的,则D为Al元素;E的价电子层中的未成对电子数为4,则E为Fe,电子排布式为[Ar]3d64s2,以此来解答.
解答 解:由上述分析可知,A为C,B为N,C为O,D为Al,E为Fe,
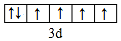
(1)D元素基态原子的价电子排布式为3s23p1,E2+价电子的轨道表示式为 ,故答案为:3s23p1;
,故答案为:3s23p1; ;
;
(2)非金属性越强、电负性越大,第一电离能越大,则5种元素中电负性最大的元素是O,且N的2p电子半满为稳定状态,则A、B、C三种元素的第一电离能由大到小的顺序为N>O>C,故答案为:O;N>O>C;
(3)具有相同电子结构的离子中原子序数大的离子半径小,则B、C、D的简单离子的半径由大到小的顺序为N3->O2->Al3+,故答案为:N3->O2->Al3+;
(4)C的核外有18个电子的氢化物为过氧化氢,其电子式为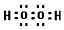 ,故答案为:
,故答案为: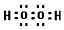 .
.
点评 本题考查原子结构与元素周期律,为高频考点,把握元素的性质、电子排布等来推断元素为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.


 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源:2016-2017学年重庆市高二上半期考试化学卷(解析版) 题型:选择题
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如下图,下列表述中正确的是
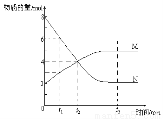
A.反应的化学方程式为: N == 2M
B.t2时,反应物和生成物的浓度相等,达到平衡
C.当M、N都是气体时增大压强,N物质的量减少
D.升高温度,平衡常数K增大,则反应的△H<0
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
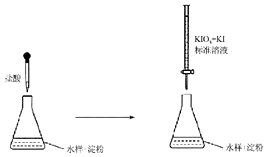 含硫化合物在生产生活中应用广泛,科学使用对人体健康及环境保持意义重大.
含硫化合物在生产生活中应用广泛,科学使用对人体健康及环境保持意义重大.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、K+、Cl-、NO3- | B. | Cu2+、K+、SO42-、NO3- | ||
| C. | Na+、Ag+、NO3-、HCO3- | D. | Na+、NH4+、CO32-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大 | |
| B. | 25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大 | |
| C. | 25℃时,Mg(OH)2固体在20 mL 0.01 mol•L-1氨水中的Ksp比在20 mL 0.01 mol•L-1 NH4Cl溶液中的Ksp小 | |
| D. | 25℃时,向二者的饱和溶液中分别加水,平衡均向沉淀溶解方向移动,c(Mg2+)均增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱性溶液中可能大量存在Na+、I-、SO42-、ClO- | |
| B. | 弱碱性溶液中可能大量存在K+、Cl-、HCO3-、AlO2- | |
| C. | Fe(NO3)3溶液中加入足量HI溶液的反应:2Fe3++2I-=2Fe2++I2 | |
| D. | 向白色ZnS沉淀上滴加CuSO4溶液,白色沉淀变黑的离子方程式:ZnS(s)+Cu2+(aq)=CuS(s)+Zn2+(aq) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com