
化学—化学与技术(15分)
明矾石是制取钾肥和氢氧化铝的重要原料,明矾石的组成和明矾相似,此外还含有氧化铝和少量氧化铁杂质。具体实验步骤如下图所示:
根据上述图示,完成下列填空:
(1)明矾石焙烧后用稀氨水浸出。配制500mL稀氨水(每升含有39.20g氨)需要取浓氨水(每升含有251.28g氨)__________mL,用规格为_______mL量筒量取。
(2)氨水浸出后得到固体混合体系,过滤,滤液中除K+、SO42-外,还有大量的NH4+。检验NH4+的方法是______________________________________________。
(3)写出沉淀物中所有物质的化学式________________________________________。
(4)滤液I的成分是水和______________。
(5)为测定混合肥料K2SO4、(NH4)2SO4中钾的含量,请完善下列步骤:
①称取钾氮肥试样并溶于水,加入足量______溶液,产生白色沉淀。
②___________、__________、_________(依次填写实验操作名称)。
③冷却、称重。
(6)若试样为mg,沉淀的物质的量为nmol,则试样中K2SO4的物质的量为:___________mol(用含有m、n的代数式表示)。
 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源: 题型:
下列溶液一定呈中性的是
A.pH=7的溶液 B.c(H+)=c(OH-)=10-6mol/L的溶液
C.使石蕊试液呈紫色的溶液 D.酸与碱恰好完全反应生成正盐的溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组物质相互反应时,改变反应的条件或者反应物的物质的量之比,生成的产物不变的是( )
A.Na与氧气 B.澄清的石灰水与二氧化碳
C.碳与氧气 D.过氧化钠和水
查看答案和解析>>
科目:高中化学 来源: 题型:
置换反应的通式可表示为:
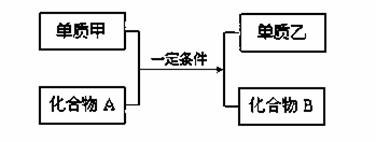
单质甲、乙和化合物A、B为中学常见物质,请回答下列问题:
(1)单质甲是生活中用途最广泛的金属,单质乙是最轻的气体,写出离子方程式:
。
(2)若化合物A常温下呈液态,化合物B的焰色反应呈黄色,则该反应的化学方程式为 。
(3)若乙是一种红色金属单质,化合物B的溶液呈浅绿色,则该反应的离子方程式为
。
(4)工业上利用置换反应原理制备一种半导体材料,写出该反应的化学方程式
。
(5)若单质乙是黑色非金属固体单质,化合物B是一种白色金属氧化物,则该反应的化学方程式 。
(6)若化合物B为黑色磁性晶体,,气体单质乙能在空气中燃烧,写出该反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作能达到目的的是
A.除去苯中混有的少量苯酚:加入适量NaOH溶液,振荡、静置后分液
B.除去乙酸乙酯中混有的少量乙酸:加入NaOH溶液并加热,振荡、静置后分液
C.检验卤代烃中的卤原子:取少量液体与NaOH溶液共热后滴加AgNO3溶液
D.检验FeCl3溶液中是否含有Fe2+:取少量溶液先滴加氯水,再滴加KSCN溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组离子在水溶液中能大量共存的是
A.CH3COO-、 Cl- 、K+、 H+ B. SO42-、Cl-、Ba2+、Na+
C.Cl-、NO3-、NH4+、Na+ D.HCO3-、NO3-、Al3+、K+
查看答案和解析>>
科目:高中化学 来源: 题型:
醋酸溶液中存在电离平衡CH3COOH H++CH3COO-,下列叙述正确的是
H++CH3COO-,下列叙述正确的是
A.0.10mol/L醋酸溶液中粒子浓度的关系满足:c(CH3COOH)>c(H+)>c(CH3COO-)>c(OH-)
B.CH3COOH溶液中加少量的CH3COONa固体,平衡逆向移动
C.0.10mol/L的CH3COOH溶液中加水稀释,溶液中c(OH-)减小
D.常温下pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合后,溶液pH=7
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质中的杂质(括号内的物质)除去时,所使用的试剂和主要操作都正确的是
| 选项 | 物质 | 使用的试剂 | 主要操作 |
| A | 乙醇(水) | 金属钠 | 过滤 |
| B | 乙酸乙酯(乙酸) | 饱和碳酸钠溶液 | 分液 |
| C | 苯(苯酚) | 浓溴水 | 振荡、分液 |
| D | 乙烷(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
三氟化氮是一种无色、无味、无毒且不可燃的气体,在半导体加工,太阳能电池制造和液晶显示器制造中得到广泛应用。NF3是一种三角锥型分子,键角102 °,沸点-129 ℃;可在铜的催化作用下由F2和过量NH3反应得到。
(1)写出制备 NF3的化学反应方程式: 。
(2)NF3的沸点比NH3的沸点(-33 ℃)低得多的主要原因是 。
(3)与铜属于同一周期,且未成对价电子数最多的元素基态原子核外电子排布式为 。
(4)根据下列五种元素的第一至第四电离能数据(单位:kJ·mol-1 ),回答下面各题:
| 元素代号 | I1 | I2 | I3 | I4 |
| Q | 2080 | 4000 | 6100 | 9400 |
| R | 500 | 4600 | 6900 | 9500 |
| S | 740 | 1500 | 7700 | 10500 |
| T | 580 | 1800 | 2700 | 11600 |
| U | 420 | 3100 | 4400 | 5900 |
①在周期表中,最可能处于同一族的是 和 。
②T元素最可能是 区元素。若T为第二周期元素,E是第三周期元素中原子半径最小的元素,则T、E形成化合物的空间构型为 ,其中心原子的杂化方式为 。
⑸与铜同周期的另一种元素钴(Co)可形成分子式均为Co(NH3)5BrSO4的两种配合物,其中一种化学式为[Co(NH3)5Br]SO4,往其溶液中加BaCl2溶液时,产生的现象是 ;往另一种配合物的溶液中加入BaCl2溶液时,无明显现象,若加入AgNO3溶液时,产生淡黄色沉淀,则第二种配合物的化学式为 。
⑹在自然界中TiO2有金红石、板钛矿、锐钛矿三种晶型,其中
金红石的晶胞如右图所示,则其中Ti4+的配位数为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com