
 常温下,H3PO4与NaOH溶液反应的体系中,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH 的关系如图所示[已知Ca3(PO4)2难溶于水].下列有关说法不正确的是( )
常温下,H3PO4与NaOH溶液反应的体系中,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH 的关系如图所示[已知Ca3(PO4)2难溶于水].下列有关说法不正确的是( )| A. | H3PO4的Ka1=10-2.1,HPO42-的水解平衡常数为10-6.8 | |
| B. | pH=13时,溶液中各微粒浓度大小关系为:c(Na+)>c(HPO42-)>c(PO43-)>c(OH-)>c(H+) | |
| C. | Na2HPO4 溶液显碱性,若向溶液中加入足量的CaCl2 溶液,溶液则显酸性 | |
| D. | 为获得尽可能纯的NaH2PO4,pH应控制在4~5.5左右 |
分析 A.根据电离方程式HPO42-?PO43-+H+,结合各物质的浓度计算,水解常数可以利用离子积常数、电离平衡常数计算得到;
B.由图象可知,在pH=13时,c(HPO42-)<c(PO43-);
C.Na2HPO4溶液显碱性,若向溶液中加入足量的CaCl2溶液,生成Ca3(PO4)2沉淀,促进HPO42-的电离;
D.要获得尽可能纯的NaH2PO4,pH应控制在4~5.5之间;
解答 解:由图象可知横坐标每一小格代表0.5个pH单位,则
A.电离方程式为,H2PO4-?HPO42-+H+,则H3PO4的Ka2=$\frac{1{0}^{-7.2}×0.5}{0.5}$=10-7.2,电离方程式为,HPO42-?PO43-+H+,H3PO4的Ka3=$\frac{1{0}^{-12.2}×0.5}{0.5}$=10-12.2,HPO42-的水解平衡常数=$\frac{c(O{H}^{-})c({H}_{2}P{{O}_{4}}^{-})}{c(HP{{O}_{4}}^{2-})}$×$\frac{c({H}^{+})}{c({H}^{+})}$=$\frac{Kw}{K{a}_{2}}$=$\frac{1{0}^{-14}}{1{0}^{-7.2}}$=10-6.8,故A正确;
B.由图象可知,pH=12.25时,c(HPO42-)=c(PO43-),在pH=13时,c(HPO42-)<c(PO43-),故B错误;
C.Na2HPO4溶液显碱性,若向溶液中加入足量的CaCl2溶液,生成Ca3(PO4)2沉淀,促进HPO42-的电离,溶液则显酸性,故C正确;
D.由图象可知,要获得尽可能纯的NaH2PO4,pH应控制在4~5.5之间,故D正确;
故选B.
点评 本题考查酸碱混合的定性判断和计算,侧重于学生的分析能力和计算能力的考查,为高考常见题型和高频考点,注意把握图象所给信息,为解答该题的关键,难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 1s22s22P6 | B. | 1s22s22P33s1 | C. | 1s22s22P63s2 | D. | 1s22s22P63s23P6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
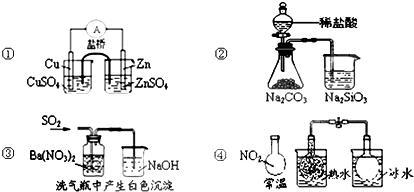
| A. | 图①能组成Zn、Cu原电池 | B. | 图②能证明非金属性Cl>C>Si | ||
| C. | 图③白色沉淀为BaSO3 | D. | 图④说明反应2NO2?N2O4(无色)△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2个 | B. | 3个 | C. | 4个 | D. | 5个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
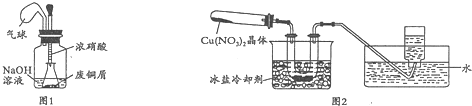
| 实验序号 | 1 | 2 | 3 | 4 |
| 温度/℃ | 35 | 50 | 70 | 95 |
| 样品颜色 | 深蓝色 | 深蓝色 | 浅绿色 | 暗蓝色 |
| 样品中碱式碳酸铜的质量分数/% | 90.9 | 92.7 | x | 92.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 医疗上常用75%的酒精杀菌消毒 | |
| B. | 由于分子间氢键的存在,NH3易液化,H2O常温下呈液态 | |
| C. | 雾霾公益调查纪录片《穹顶之下》的发布引起了人们的关注,雾霾属于胶体 | |
| D. | 氢气是理想的绿色能源,贮氢合金的发现和应用解决了氢气贮存运输的难题,贮氢金属与氢气发生化学反应,形成氢化物,达到贮存氢气的目的 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com