
| A. | 向碘化亚铁溶液中滴加溴的四氯化碳溶液2Br2+2Fe2++2I-═I2+4Br-+2Fe3+ | |
| B. | 向含等物质的量浓度AgNO3和Cu(NO3)2的溶液中缓慢加入镁粉4Cu2++2Ag++5Mg═4Cu+2Ag+5Mg2+ | |
| C. | 氢氧化铁溶于氢碘酸中:2Fe(OH)3+6H++2I-═2Fe2++I2+6H2O | |
| D. | 向明矾溶液中加入Ba(OH)2溶液至生成的沉淀物质的量最多:Al3++2SO42-+2Ba2++4OH-═AlO2-+2BaSO4↓+2H2O |
分析 A.碘离子还原性强于二价铁离子,溴离子先氧化碘离子;
B.设银离子、铜离子都是2mol,则消耗镁粉物质的量为3mol,置换铜和银;
C.氢氧化铁溶于氢碘酸中,发生氧化还原反应生成碘化亚铁、碘、水;
D.沉淀最多时为铝离子全部生成沉淀时.
解答 解:A.向碘化亚铁溶液中滴加溴的四氯化碳溶液,离子方程式:3Br2+2Fe2++4I-═3I2+6Br-+2Fe3+,故A错误;
B.向含等物质的量浓度AgNO3和Cu(NO3)2的溶液中缓慢加入镁粉:2Cu2++2Ag++3Mg═2Cu+2Ag+3Mg2+,故B错误;
C.氢氧化铁溶于氢碘酸中的离子反应为2I-+2Fe(OH)3+6H+═2Fe2++6H2O+I2,故C正确;
D.明矾为KAl(SO4)2?12H2O,1mol明矾加入1.5molBa(OH)2溶液生成沉淀的物质的量最多,反应的离子方程式为2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓+3H2O,故D错误;
故选C.
点评 本题考查离子方程式的书写,题目难度不大,注意从化学式、离子符号、电荷守恒以及氧化还原、物质的用量的多少判断是否符合反应实际情况.


科目:高中化学 来源: 题型:选择题
| A. |  互为同分异构体 互为同分异构体 | |
| B. |  与 与 两种烃互为同系物 两种烃互为同系物 | |
| C. | 甲苯与溴蒸汽的反应产物受反应条件的影响而不同 | |
| D. | H2和D2互为同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HOCH2CHO能发生取代反应、加成反应、氧化反应和还原反应 | |
| B. | 乙醇醛糖属于醛和糖的混合物 | |
| C. | HOCH2CHO与乙酸、甲酸甲酯互为同分异构体 | |
| D. | 乙醇醛糖与葡萄糖具有相似的化学性质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 44g CO2含有的原子数目为 NA | |
| B. | 1L1 mol•L-1 的(NH4)2SO4 溶液中含有的 NH4+数目为2NA | |
| C. | 足量的 MnO2与 100mL12 mol•L-1的浓盐酸充分反应,转移的电子数目为 0.6 NA | |
| D. | 常温常压下,18mL 水含有的分子数目约为 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.015 | B. | 0.225 | C. | 0.035 | D. | 0.045 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
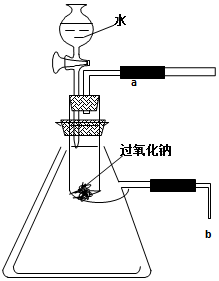 用脱脂棉包住0.39g过氧化钠粉末,置于石棉网上,往脱脂棉上滴几滴水,可观察到脱脂棉剧烈燃烧起来.
用脱脂棉包住0.39g过氧化钠粉末,置于石棉网上,往脱脂棉上滴几滴水,可观察到脱脂棉剧烈燃烧起来.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 测试时间/h | 0 | 1 | 2 | 3 | 4 |
| 雨水的pH | 4.73 | 4.62 | 4.56 | 4.55 | 4.55 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 物质 | 组成和结构信息 |
| a | 含有A的二元离子化合物 |
| b | 含有非极性共价键的二元离子化合物,且原子数之比为1:1 |
| c | 化学组成为BDF2 |
| d | 只存在一种类型作用力且可导电的单质晶体 |
 ;d的晶体类型是金属.
;d的晶体类型是金属.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com