
研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。
(1)CO可用于炼铁,已知:Fe2O3(s)+3C(s)=2Fe (s)+3CO(g) ΔH 1=+489.0 kJ· mol-1,
C(s) +CO2(g)=2CO(g) ΔH 2 =+172.5 kJ·mol-1, 则CO还原Fe2O3(s)的热化学方程式为 。
(2)CO与O2设计成燃料电池(以KOH溶液为电解液)。该电池的负极反应式为 。
(3)CO2和H2充入一定体积的恒容密闭容器中,在两种温度下发生反应:CO2(g) +3H2(g) 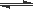 CH3OH(g) +H2O(g) 测得CH3OH的物质的量随时间的变化如图5。
CH3OH(g) +H2O(g) 测得CH3OH的物质的量随时间的变化如图5。
|

①该反应的ΔH 0(填“大于或小于”),曲线I、Ⅱ对应的平衡常数大小关系为
KⅠ KⅡ (填“>、=或<”)。
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
| 容 器 | 甲 | 乙 |
| 反应物投入量 | 1 mol CO2、3 mol H2 | a molCO2、3a molH2、 b molCH3OH(g)、b molH2O(g) |
若甲中平衡后气体的压强为开始的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则b的取值范围为 。
(4)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2。紫外光照射时,在不同催化剂(I、II、III)作用下,CH4产量随光照时间的变化如图6。在0~15小时内,CH4的平均生成速率I、II和III从小到大的顺序为 (填序号)。
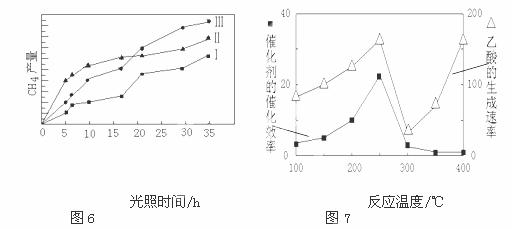
(5)以TiO2/Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。
在不同温度下催化剂的催化效率与乙酸的生成速率的关系如图7。
①当温度在 范围时,温度是乙酸生成速率的主要影响因素。
②Cu2Al2O4可溶于稀硝酸,稀硝酸还原产物为NO,写出有关的离子方程式 。
【答案】(1) Fe2O3 (s)+ 3CO(g)=2Fe(s)+ 3CO2 (g) △H =-28.5 kJ·mol-1
(2)CO + 4OH-― 2e-= CO32-+ 2H2O(3)①> < ②0.4<c≤1(4)II>III>I
(5)①300℃~400℃ ②3Cu2Al2O4+32H++2NO3-= 6Cu2++ 6Al3++2NO↑+16H2O
【解析】(1) 根据盖斯定律,热化学方程式①-②×3,得出Fe2O3 (s)+ 3CO(g)=2Fe(s)+ 3CO2 (g) △H =-28.5 kJ·mol-1
(2)负极失去电子,CO为负极产生CO32-,氧气为正极,负极为CO + 4OH-― 2e-= CO32-+ 2H2O
(3)①由图像判断Ⅱ温度高于I,但I甲醇物质的量多,温度高平衡正向移动,平衡常数大,正反应吸热;该反应的ΔH>0,KⅠ<KⅡ ,②平衡后物质的量为4×0.8=3.2mol Δn=4-3.2=0.8mol CO2(g) +3H2(g) CH3OH(g) +H2O(g) Δn=2
CH3OH(g) +H2O(g) Δn=2
起始量 1 3
转化量0.4 1.2 0.4 0.4 0.8
平衡量 0.6 1.8 0.4 0.4
该反应与原反应等效平衡,为全等等效,即等效转化为反应物量相等,若保持平衡逆向移动,则C>0.4,C最高为1,所以C的取值范围为0.4<c≤1
(4) 由图Ⅱ可知,CH4的平均生成速率顺序为II>III>I
(5)①从300℃开始,催化剂对反应基本没有影响,温度升高,生成乙酸速率增大,所以①当温度在300℃~400℃范围时,温度是乙酸生成速率的主要影响因素;②Cu2Al2O4中铜为+1价,与硝酸反应被氧化为+2价,硝酸被还原为NO。反应的离子方程式为3Cu2Al2O4+32H++2NO3-= 6Cu2++ 6Al3++2NO↑+16H2O。


科目:高中化学 来源: 题型:
关于0.1 mol·L-1 NaHCO3溶液,下列说法正确的是
A.溶质水解反应:HCO3- +H2O H3O++CO32-
H3O++CO32-
B.离子浓度关系:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-)
C.微粒浓度关系:c(Na+)>c(HCO3-) >c(H2CO3)>c(CO32-)
D.微粒浓度关系:c(Na+)=2[c(H2CO3)+c(HCO3-)+c(CO32-)]
查看答案和解析>>
科目:高中化学 来源: 题型:
影响化学反应速率的因素很多,某校化学小组用实验的方法进行探究。
实验药品:铜、铁、镁、0.5mol/LH2SO4、2mol/LH2SO4、、18.4mol/LH2SO4
【I】甲同学研究的实验报告如下表:
| 实验步骤 | 现象 | 结论 |
| ①分别取等体积的2mol/L的硫酸于试管中 ②分别投入大小、形状相同的铜、铁、镁 | 反应速率镁>铁,铜不反应 | 金属的性质越活泼,反应速率越快 |
(1)甲同学的实验目的是 ;要得出正确的实验结论,还需控制的实验条件是 。
【II】乙同学为了更精确的研究浓度对反应速率的影响,利用下图所示装置进行实验。
(2)乙同学在实验中应该测定的数据是 。
(3)乙同学完成该实验应选用的实验药品 。不选用某浓度的硫酸,理由是 。
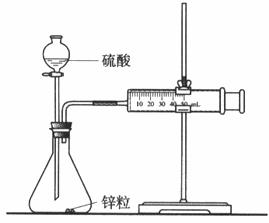
测量锌与硫酸反应速率的装置
查看答案和解析>>
科目:高中化学 来源: 题型:
室温时,向20 mL 0.1 mol·L-1的醋酸溶液中不断滴入0.1 mol·L-1的NaOH溶液,溶液的pH变化曲线,如图2所示。在滴定过程中,关于溶液中离子浓度大小关系的描述不正确的是( )
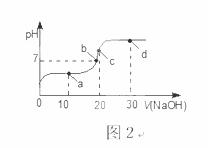
A.a点时:c( CH3COOH)>c( Na+)>c( CH3COO-)>c( H+)>c( OH -)
B.b点时:c( Na+) =c( CH3COO-)>c(H+)=c( OH-)
C.c点时:c(OH-)=c(CH3COOH) +c(H+)
D.d点时:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
生活离不开化学。下列对生活中各种物质的认识不正确的是( )
A.酒精可用于消毒杀菌
B.液化石油气的主要成分属于烃类
C.塑料、油脂、橡胶均属于高分子化合物
D.普通肥皂的主要成分是高级脂肪酸钠盐
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验事实可以用同一反应原理解释的是( )
A.活性炭、氯气都能使品红溶液退色
B.乙酸、葡萄糖都能与新制Cu(OH)2悬浊液反应
C.乙烯、氯乙烯都能使溴水退色
D.淀粉、蛋白质都能发生显色(或颜色)反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关材料的说法不正确的是( )
A.传统的无机非金属材料虽然有不少优点,但质脆,经不起热冲击
B.新型无机非金属材料虽然克服了传统无机非金属材料的缺点,但强度比较差
C.高温结构材料具有能经受高温,不怕氧化,耐酸碱腐蚀,硬度大,耐磨损,密度小的优点
D.新型无机非金属材料特征之一是具有电学特性
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下在容积固定的密闭容器中,下列反应达到平衡:
CO(g)+H2O(g) 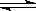 CO2(g)+H2(g)
CO2(g)+H2(g)
| 初始投料比n(CO)n(H2O) | CO转化率 | H2O转化率 |
| 1:1 | 0.5 | 0.5 |
| 1:2 | 0.67 | 0.335 |
| 1:3 | 0.75 | 0.25 |
(1)已知CO和H2的燃烧热分别为283kJ/mol、285.8kJ/mol,H2O(g)=H2O(l)△H= -44kJ/mol,写出CO(g)和H2O(g)反应的热化学方程式 。
(2)该反应的平衡常数为 。该温度下,向该容器中充入1mol CO、3molH2O(g)、2mol CO2、1.5molH2,则起始时该反应速率V正 V逆(填“>”、“<”或“=”)
(3)结合表中数据判断下列说法中正确的是 。
A.增加H2O(g)的量,CO的转化率升高而H2O(g)的转化率降低
B.若CO与H2O(g)的转化率相同,则二者的初始投入量一定相同
C.CO和H2O(g)初始物质的量之比等于二者转化率之比
D.当CO与H2O(g)物质的量之比为1:4时,CO的转化率为0.85
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com