
【题目】利用高浓度含砷废水(主要成分为H3AsO3)制取As2O3的工艺流程如下图所示。

已知:As2S3(s)+3S2-(aq)![]() 2AsS33-(aq)
2AsS33-(aq)
(1)H3AsO3中As元素的化合价为______;H3AsO3的第一步电离方程式为:________。
(2)步骤I加入FeSO4的作用是______________________。
(3)步骤Ⅱ发生反应的化学方程式为___________________。步骤III“氧化脱硫”过程中被氧化的元素是___________(填元素符号)。
(4)步骤IV发生反应的离子方程式为________________________。
(5)利用反应AsO43-+2I-+2H+![]() AsO33-+I2+H2O设计成原电池,起始时在甲、乙两池中分别加入图示药品并连接装置(a、b均为石墨电极)。
AsO33-+I2+H2O设计成原电池,起始时在甲、乙两池中分别加入图示药品并连接装置(a、b均为石墨电极)。
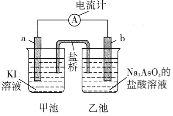
①起始时,b电极的电极反应式为__________________。
②一段时间后电流计指针不发生偏转。欲使指针偏转方向与起始时相反,可采取的措施是______________________________(举一例)。
【答案】+3 H3AsO3![]() H++H2AsO3- 沉淀过量的S2-,使As2S3(s)+3S2-(aq)
H++H2AsO3- 沉淀过量的S2-,使As2S3(s)+3S2-(aq)![]() 2AsS33-(aq)平衡左移,提高沉砷效率 As2S3+6NaOH=Na3AsO3+Na3AsS3+3H2O S、As 2AsO43-+2SO2+2H+=As2O3+2SO42-+H2O AsO43-+2e-+2H+=AsO33-+ H2O 向乙中加入Na3AsO3固体或加入碱
2AsS33-(aq)平衡左移,提高沉砷效率 As2S3+6NaOH=Na3AsO3+Na3AsS3+3H2O S、As 2AsO43-+2SO2+2H+=As2O3+2SO42-+H2O AsO43-+2e-+2H+=AsO33-+ H2O 向乙中加入Na3AsO3固体或加入碱
【解析】
(1)根据化合物中元素化合价的代数和等于0判断;H3AsO3是三元弱酸,根据多元弱酸分步电离书写电离方程式;
(2)根据示意图可知步骤I加入FeSO4的作用是使过量的S2-变为沉淀;
(3)步骤Ⅱ中NaOH与As2S3反应产生Na3AsO3、Na3AsS3及水,根据原子守恒、电子守恒可得反应方程式;根据被氧化的元素反应后化合价会升高分析;
(4) SO2将Na3AsO4还原为As2O3,SO2被氧化为H2SO4,然后根据电子守恒、原子守恒可得反应的方程式;
(5)①根据反应AsO43-+2I-+2H+![]() AsO33-+I2+H2O可知,若设计原电池,I-失去电子,作负极,AsO43-在正极上发生还原反应分析;
AsO33-+I2+H2O可知,若设计原电池,I-失去电子,作负极,AsO43-在正极上发生还原反应分析;
②若再构成原电池,电极相反,则在左边发生还原反应,在右边发生氧化反应。
(1) H3AsO3中H元素化合价为+1价,O元素化合价为-2价,根据化合物中各种元素化合价的代数和等于0,可知As元素的化合价为+3价;H3AsO3的第一步电离方程式为:H3AsO3![]() H++H2AsO3-;
H++H2AsO3-;
(2)步骤I加入FeSO4的作用是使过量的S2-变为沉淀,Fe2++S2-=FeS↓,由于c(S2-)降低,使As2S3(s)+3S2-(aq)![]() 2AsS33-(aq)平衡逆向移动,从而可提高沉砷效率;
2AsS33-(aq)平衡逆向移动,从而可提高沉砷效率;
(3)步骤Ⅱ中NaOH与As2S3反应产生Na3AsO3、Na3AsS3及水,根据原子守恒、电子守恒可得反应方程式:As2S3+6NaOH=Na3AsO3+Na3AsS3+3H2O;
(4)由反应前后物质中所含元素化合价分析可知:S元素化合价由反应前Na3AsS3的-2价变为反应后S单质的0价,化合价升高,失去电子,被氧化;As元素的化合价由反应前Na3AsO3、Na3AsS3的+3价变为反应后Na3AsO4的+5价,化合价升高,失去电子,被氧化,故被氧化的元素有S、As;
(4)步骤IV中SO2具有还原性,将Na3AsO4还原为As2O3,SO2被氧化为H2SO4,发生反应的离子方程式为:2AsO43-+2SO2+2H+=As2O3+2SO42-+H2O;
(5)①根据方程式可知:I-在负极失去电子,发生氧化反应,电极式为:2I--2e-=I2,在正极上AsO43-获得电子,发生还原反应,电极反应式为:AsO43-+2e-+2H+=AsO33-+ H2O;
②一段时间后电流计指针不发生偏转。欲使指针偏转方向与起始时相反,则左边发生还原反应右边发生氧化反应,可采取的措施是向乙中加入Na3AsO3固体或加入碱消耗I2,反应就可以发生。


科目:高中化学 来源: 题型:
【题目】合理应用和处理氮的化合物,在生产生活中有重要意义。
(1)尿素[CO(NH2)2]是一种高效化肥,也是一种化工原料。
①以尿素为原料在一定条件下发生反应:
CO(NH2)2(s)+H2O(l)![]() 2NH3(g)+CO2(g)△H=+133.6 kJ/mol。关于该反应的下列说法正确的是____________________(填序号)。
2NH3(g)+CO2(g)△H=+133.6 kJ/mol。关于该反应的下列说法正确的是____________________(填序号)。
a.从反应开始到平衡时容器中混合气体的平均相对分子质量保持不变
b.在平衡体系中增加水的用量可使该反应的平衡常数增大
c.降低温度使尿素的转化率增大
d. 缩小容器的体积,平衡向逆反应方向移动,达新平衡时NH3的浓度大于原平衡
②尿素在一定条件下可将氮的氧化物还原为氮气。
已知:
再结合①中的信息,则反应2CO(NH2)2(s)+6NO(g)![]() 5N2(g)+2CO2(g)+4H2O(l)的△H =_______kJ/mol。
5N2(g)+2CO2(g)+4H2O(l)的△H =_______kJ/mol。
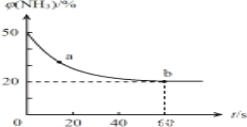
③密闭容器中以等物质的量的NH3和CO2为原料,在120℃、催化剂作用下反应生成尿素:CO2(g)+2NH3(g)![]() CO(NH2)2(s)+H2O(g),混合气体中NH3的物质的量百分含量随时间变化关系如图所示。则a点的正反应速率v正(CO2)______b点的逆反应速率v逆(CO2)(填“>”、“=”或“<”);氨气的平衡转化率为________________。
CO(NH2)2(s)+H2O(g),混合气体中NH3的物质的量百分含量随时间变化关系如图所示。则a点的正反应速率v正(CO2)______b点的逆反应速率v逆(CO2)(填“>”、“=”或“<”);氨气的平衡转化率为________________。
(2)NO2会污染环境,可用Na2CO3溶液吸收NO2并生成CO2。已知9.2g NO2和Na2CO3溶液完全反应时转移电子0.1mol,此反应的离子方程式为_________;恰好反应后,使溶液中的CO2完全逸出,所得溶液呈弱碱性,则溶液中离子浓度大小关系是c(Na+)>______。
(3)用肼燃料电池为电源,通过离子交换膜电解法控制电解液中OH-的浓度来制备纳米Cu2O,装置如图所示:
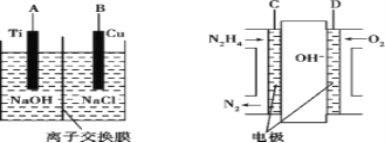
上述装置中B电极应连电极__(填“C”或“D”)。该电解池中的离子交换膜为__(填“阴”或“阳”)离子交换膜。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要0.1 mol/L NaOH溶液450 mL和0.5 mol/L H2SO4溶液450 mL。根据这两种溶液的配制情况回答下列问题:
A B
B C
C![]() D
D![]() E
E
(1)如图所示的仪器中配制溶液肯定不需要的是____(填序号)。仪器C的名称是____。本实验所需玻璃仪器E的规格和名称是____。
(2)下列操作中,容量瓶所不具备的功能有____ (填序号)。
A.配制一定体积准确浓度的标准溶液 B.长期贮存溶液
C.用来加热溶解固体溶质 D.量取220 mL溶液
(3)在配制NaOH溶液的实验中,其他操作均正确,若定容时仰视刻度线,则所配制溶液的浓度将____0.1 mol/L(填“大于”“等于”或“小于”,下同)。若NaOH溶液未冷却即转移至容量瓶定容,则所配制溶液浓度将_____0.1 mol/L。
(4)根据计算得知:所需质量分数为98%、密度为1.84 g/cm3的浓硫酸的体积为________mL(计算结果保留一位小数)。如果实验室有10 mL、25 mL、50 mL规格的量筒,应选用_____mL的最好。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国地大物博、资源丰富,其中山西的煤、大庆的石油,四川的天然气较为出名。下列有关化石能源叙述正确的是
A.煤的干馏为化学变化B.汽油为纯净物
C.天然气为二次能源D.裂化的目的是提高乙烯产量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新春佳节少不了饮酒,土法酿造葡萄酒(只加糖的纯天然酿酒法)容易出问题,有报道说,喝了自制葡萄酒差点失明。主要原因是发酵过程产生的菌种多达百种,难以控制,而产生对神经有毒的甲醇等物质。科学酿酒须加SO2等辅料。我国国家标准(GB2760-2014)规定葡萄酒中SO2的残留量≤0.25g/L。
(1)葡萄酒中添加SO2的作用可能是________。
A.抗氧化 B. 氧化细菌 C.增酸作用 D. 漂白
I.实验方案一
利用SO2的漂白性检测干白葡萄酒(液体为无色)中的SO2或H2SO3。设计如图的实验:
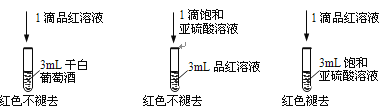
(2)甲同学得出实验结论: 干白葡萄酒中不含SO2或H2SO3。这个结论是否合理?说明理由___________。
Ⅱ.实验方案二
如图是在实验室进行二氧化硫制备与性质实验的组合装置,部分固定装置未画出。
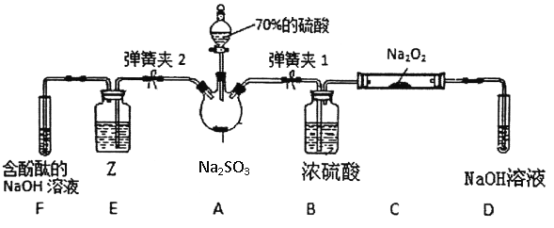
(3)关闭弹簧夹2,打开弹簧夹1,注入硫酸至浸没瓶中固体,写出A装置反应的化学方程式______,C中每消耗2molNa2O2,则转移电子数___________。
(4)关闭弹簧夹1后,打开弹簧夹2,残余气体进入E、F中,为了证明SO2有还原性,并从绿色化学的角度考虑,则Z试剂可以是____,反应的离子反应方程式为____________,现象是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C三种可溶性正盐,阴、阳离子各不相同,其阴离子的摩尔质量依次增大(按A、B、C的顺序),将等物质的量的A、B、C溶于水,所得溶液中只含有Fe3+、K+、SO![]() 、NO
、NO![]() 、Cl-五种离子,同时生成一种白色沉淀。
、Cl-五种离子,同时生成一种白色沉淀。
请回答下列问题:
(1)经检验,三种正盐中还含有下列选项中的一种离子,该离子是 。
A.Na+ B.Mg2+ C.Cu2+ D.Ag+
(2)三种正盐的化学式分别是:A ,B ,C 。
(3)若将A、B、C三种正盐按一定比例溶于水后,所得溶液中只含有Fe3+、SO![]() 、NO
、NO![]() 、K+四种离子且物质的量之比依次为1∶2∶3∶4,则A、B、C三种正盐的物质的量之比为 。
、K+四种离子且物质的量之比依次为1∶2∶3∶4,则A、B、C三种正盐的物质的量之比为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如下能量关系示意图,下列说法正确的是

A. 1 mol C(g)与1 mol O2(g)的能量之和为393.5 kJ
B. 反应2CO(g)+O2(g) ==2CO2(g)中,生成物的总能量大于反应物的总能量
C. 由C→CO的热化学方程式为:2C(s)+O2(g) ==2CO(g) ΔH= 221.2 kJmol1
D. 热值指一定条件下单位质量的物质完全燃烧所放出热量,则CO热值ΔH= 10.1 kJmol1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,把 2.5 mol A 和 2.5 mol B混合盛入容积为 2 L的密闭容器里,发生如下反应: 3A(g)+B(g) ![]() x C(g) + 2D(g), 经 5 s反应达平衡,在此 5 s 内 C的平均反应速率为 0.2 mol·L-1·s-1,同时生成1 mol D,下列叙述中不正确的是
x C(g) + 2D(g), 经 5 s反应达平衡,在此 5 s 内 C的平均反应速率为 0.2 mol·L-1·s-1,同时生成1 mol D,下列叙述中不正确的是
A. x=4
B. 达到平衡状态时 A 的物质的量浓度为 c(A)=1.0 mol·L-1
C. 5s 内 B的反应速率 v(B)=0.05 mol·(L·s)-1
D. 达到平衡状态时容器内气体的压强与起始时压强比为 6:5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有反应:mA (g) +nB (g)![]() pc (g) ,达到平衡后,当升高溫度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
pc (g) ,达到平衡后,当升高溫度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
(1)该反应的逆反应为____热反应,且m+n____p (填“>”、 “=” 、“<”)。
(2)减压时,A的质量分数______.(填“增大”、“减小”或“不变”,下同)
(3)若加入B (体积不变),则A的转化率_____,B的转化率_________。
(4)若升高溫度,则平衡时B、C的浓度之比将__________。
(5)若加入催化剂,平衡时气体混合物的总物质的量______________。
(6)若B是有色物质,A、C均无色,则加入C (体积不变)时混合物颜色______,而维持容器内压强不变,充入氖气时,混合物颜色______(填“变深”、 “变浅”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com