
下列离子方程式中正确的是( )
A.澄清的石灰水与稀盐酸反应:Ca(OH)2+2H+====Ca2++2H2O
B.钠与水的反应:Na+2H2O====Na++2OH-+H2↑
C.铜片插入硝酸银溶液中:Cu+Ag+====Cu2++Ag
D.大理石溶于醋酸的反应:CaCO3+2CH3COOH====Ca2++2CH3COO-+CO2↑+H2O
科目:高中化学 来源: 题型:
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如下图所示(图中的ΔH表示生成1 mol产物的数据)。
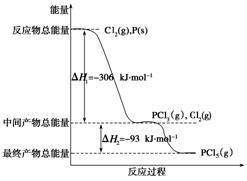
根据上图回答下列问题:
(1) P和Cl2反应生成PCl3的热化学方程式是________________________________
________________________________________________________________________。
(2) PCl5分解成PCl3和Cl2的热化学方程式是_________________________________
________________________________________________________________________。
(3)P和Cl2分两步反应生成1 mol PCl5的ΔH3=__________________,P和Cl2一步反应生成1 mol PCl5的ΔH4____ΔH3(填“大于”、“小于”或“等于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
开发氢能是实现社会可持续发展的需要。硫铁矿(FeS2)燃烧产生的SO2通过下列碘循环工艺过程既能制H2SO4,又能制H2。
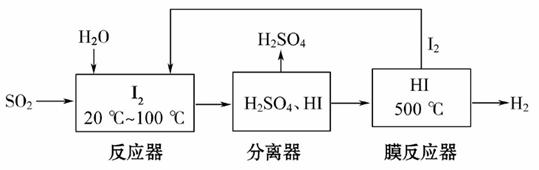
请回答下列问题:
(1)已知1 g FeS2完全燃烧放出7.1 kJ热量,FeS2燃烧反应的热化学方程式为
________________________________________。
(2)该循环工艺过程的总反 应方程式为__________________________________。
应方程式为__________________________________。
(3)用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是__________________________________。
(4)用吸收H2后的稀土储氢合金作为电池负极材料(用MH表示),NiO(OH)作为电池正极材料,KOH溶液作为电解质溶液,可制得高容量,长寿命的镍氢电池。电池充放电时的总反应为:
NiO(OH)+MH Ni(OH)2+M
Ni(OH)2+M
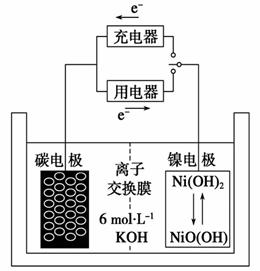
①电池放电时,负极的电极反应式为_________________________________。
②充电完成时,Ni(OH)2全部转化为NiO(OH)。若继续充电将在一个电极产生O2,O2扩散到另一个电极发生电极反应被消耗,从而避免产生的气体引起电池爆炸,此时,阴极的电极反应式为___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液一定呈中性的是( )
A.[H+]=[OH-]=10-6 mol·L-1的溶液
B.pH=7的溶液
C.使石蕊溶液呈紫色的溶液
D.酸与碱恰好完全反应生成正盐的溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
有①Na2CO3溶液 ②CH3COONa溶液 ③NaOH溶液各25 mL,物质的量浓度均为0.1 mol·L-1,下列说法正确的是( )
A.3种溶液pH的大小顺序是③>②>①
B.若将3种溶液稀释相同倍数,pH变化最大的是②
C.若分别加入25 mL 0.1 mol·L-1的盐酸后,pH最大的是①
D.若3种溶液的pH均为9,则物质的量浓度的大小顺序是③>①>②
查看答案和解析>>
科目:高中化学 来源: 题型:
某无色溶液由Na+、Ag+、Ba2+、Al3+、
[Al(OH)4]-、MnO4-、CO32-、SO42-中的若干种组成。取该溶液进行如下实验:
(A)取试液适量,加入过量稀盐酸,有气体生成,得到溶液甲
(B)向溶液甲中再加入过量碳酸氢铵溶液,有气体生成,析出白色沉淀乙,得到溶液丙
(C)向溶液丙中加入过量Ba(OH)2溶液,有气体生成,析出白色沉淀丁。
根据上述实验回答下列问题:
(1)溶液中一定不存在的离子是________________________________________。
(2)一定存在的离子是________________________________________________。
(3)生成沉淀乙的离子反应方程式是____________________________________。
(4)写出步骤(C)中产生气体的离子方程式_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
右图为元素周期表中短周期的一部分,关于Y、Z、M的说法正确的是(双选)( )
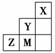
A.离子半径:M->Z2->Y-
B.Z元素形成的氧化物都是共价化合物
C.气态氢化物稳定性,Y>Z>M
D.三种元素中,M的最高价氧化物对应的水化物酸性最强
查看答案和解析>>
科目:高中化学 来源: 题型:
某气体可能含有HCl、CO2中的一种或两种,若将该气体通过AgNO3溶液,有白色沉淀生成;若将该气体通入少量澄清石灰水,无明显现象.由此可知该气体中( )
|
| A. | 只有HCl,无CO2 | B. | 只有CO2,无HCl |
|
| C. | 一定是HCl和CO2的混合气体 | D. | HCl一定有,CO2无法确定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com