
| A. | 常温常压下,14g由N2与CO组成的混合气体含有的原子数目为NA | |
| B. | 常温常压下,1molNO2气体与水完全反应,转移电子数为NA | |
| C. | 标准状况下,11.2LC2H5OH中所含的分子数为0.5NA | |
| D. | 常温常压下,17gNH3中含有的共用电子对数为4NA |
分析 A.氮气和一氧化碳的摩尔质量都是28g/mol,14g二者的混合物的物质的量为0.5mol,含有1mol原子;
B.3mol NO2气体与水完全反应生成硝酸溶液和NO气体,电子转移2mol;
C.标准状况下,11.2LC2H5OH不是气体,物质的量不是0.5mol;
D.计算物质的量n=$\frac{m}{M}$,氨气分子中含有三对共用电子对.
解答 解:A.14gN2与CO组成的混合气体的物质的量为0.5mol,0.5mol混合气体中含有1mol原子,含有的原子数目为NA,故A正确;
B.3NO2+H2O=2HNO3+NO,3mol NO2气体与水完全反应生成硝酸溶液和NO气体,电子转移2mol,1molNO2气体与水完全反应,转移电子数为$\frac{2}{3}$NA,故B错误;
C.标准状况下气体摩尔体积为22.4L/mol,11.2LC2H5OH不是气体,物质的量不是0.5mol,故C错误;
D.常温常压下,17gNH3中物质的量=$\frac{17g}{17g/mol}$=1mol,含有的共用电子对数为3NA,故D错误;
故选A.
点评 本题考查了阿伏伽德罗常数的应用,物质的量和微粒数的计算,氧化还原反应电子转移,气体摩尔体积的应用条件,掌握基础是解题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | CO2的大量排放会导致酸雨的形成 | |
| B. | 黄河三角洲的形成体现了胶体聚沉的性质 | |
| C. | 推广使用燃料电池汽车,可减少颗粒物、CO等有害物质的排放 | |
| D. | 轮船上挂锌锭防止铁腐蚀,属于牺牲阳极的阴极保护法 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

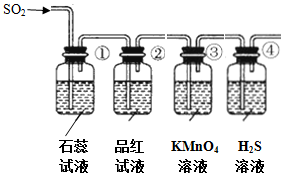
| 序号 | 实验现象 | 解释原因 |
| ① | 石蕊试液变红 | 石蕊试液变红说明SO2是酸性气体 |
| ② | 品红试液褪色 | SO2具有漂白性 |
| ③ | KMnO4溶液颜色褪色 | 反应的离子方程式5SO2+2H2O+2MnO4-=2Mn2++5SO42-+4H+ |
| ④ | 溶液变浑浊,有黄色沉淀生成 | SO2+2H2S=3S↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 MnO2是常见的氧化剂、催化剂和活性电极材料.
MnO2是常见的氧化剂、催化剂和活性电极材料.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Z>Y>X>W>Q | |
| B. | Q、X形成的化合物的电子式为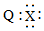 | |
| C. | 最简单氢化物的稳定性:Z>W | |
| D. | 工业上常用电解的方法制备X、Y的单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 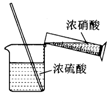 配制混酸 | B. | 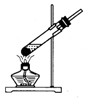 硝化反应 | C. |  分离硝基苯 | D. | 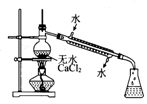 蒸馏硝基苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
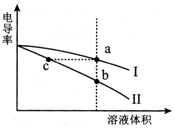 电导率是衡量电解质溶液导电能力大小的物理量.常温下,将相同体积的氢氧化钠溶液和醋酸溶液分别加水稀释,溶液的电导率随溶液体积变化的曲线如图所示.下列说法正确的是( )
电导率是衡量电解质溶液导电能力大小的物理量.常温下,将相同体积的氢氧化钠溶液和醋酸溶液分别加水稀释,溶液的电导率随溶液体积变化的曲线如图所示.下列说法正确的是( )| A. | I表示NaOH溶液加水稀释过程中溶液电导率的变化 | |
| B. | a、b、c三点溶液的pH:b>c>a | |
| C. | 将a、b两点溶液混合,所得溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| D. | a点水电离出的n(H+)等于c点水电离出的n(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y |
| Z | W |
| A. | 1项 | B. | 2项 | C. | 3项 | D. | 4项 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
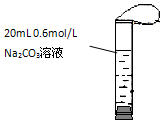 如图,将2mL浓度为6mol/L的盐酸用注射器通过橡皮塞慢慢注入,玻璃管中出现小气泡,气泡在溶液中逐渐上升的过程中消失.对该反应过程的推断不合理的是:( )
如图,将2mL浓度为6mol/L的盐酸用注射器通过橡皮塞慢慢注入,玻璃管中出现小气泡,气泡在溶液中逐渐上升的过程中消失.对该反应过程的推断不合理的是:( )| A. | 有反应CO32-+2H+→CO2↑+H2O | |
| B. | 有反应CO32-+H+→HCO3-发生 | |
| C. | 有反应CO32-+CO2+H2O→2HCO3-发生 | |
| D. | 加快盐酸注入速度不会改变反应现象 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com