
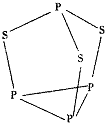
 三硫化四磷是黄绿色针状结晶,其结构如图所示,不溶于冷水,溶于叠氮酸、二硫化碳、苯等有机溶剂.在沸腾的NaOH稀溶液中会迅速水解.回答下列问题:
三硫化四磷是黄绿色针状结晶,其结构如图所示,不溶于冷水,溶于叠氮酸、二硫化碳、苯等有机溶剂.在沸腾的NaOH稀溶液中会迅速水解.回答下列问题:分析 (1)Se是S的下一周期同主族元素,其核外电子排布式为[Ar]3d104s24p4;
(2)同一周期中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第IIA族元素大于相邻元素;同一主族元素中,元素的第一电离能随着原子序数的增大而减小;同一周期中,元素的电负性随着原子序数的增大而增大,同一主族中,元素的电负性随着原子序数的增大而减小;
(3)P4S3中P原子成3个P-S键、含有一对孤对电子,杂化轨道数为4,P原子采取sp3杂化;与PO3-互为等电子体的化合物分子的化学式为SO3;
故答案为:sp3;SO3;
(4)二硫化碳与二氧化碳的结构相似,正负电荷中心重合,属于非极性分子;
(5)根据图知,每个P上1对孤对电子对,每个S有2对孤对电子对;
(6)HN3分子间存在氢键,使沸点反常的升高;
(7)以体心Na+研究,与之相邻的Cl-位于面心,晶胞中Na+的配位数为6,晶胞中Na+与Cl-之间的距离为a cm,则晶胞棱长为2a cm,晶胞体积为(2a cm)3,晶胞中Na+离子数目为1+12×$\frac{1}{4}$=4、Cl-离子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,则晶胞质量为4×$\frac{40}{{N}_{A}}$g,则晶胞密度为4×$\frac{40}{{N}_{A}}$g÷(2a cm)3=$\frac{20}{{a}^{3}{N}_{A}}$g.cm-3.
解答 解:(1)Se是S的下一周期同主族元素,其核外电子排布式为[Ar]3d104s24p4,故答案为:[Ar]3d104s24p4;
(2)同一周期中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第IIA族元素大于相邻元素;同一主族元素中,元素的第一电离能随着原子序数的增大而减小;同一周期中,元素的电负性随着原子序数的增大而增大,同一主族中,元素的电负性随着原子序数的增大而减小,第一电离能:S<P;电负性:S>P,故答案为:<;>;
(3)P4S3中P原子成3个P-S键、含有一对孤对电子,杂化轨道数为4,P原子采取sp3杂化;与PO3-互为等电子体的化合物分子的化学式为SO3;
故答案为:sp3;SO3;
(4)二硫化碳与二氧化碳的结构相似,正负电荷中心重合,属于非极性分子,故答案为:非极性;
(5)根据图知,每个P上1对孤对电子对,每个S有2对孤对电子对,1mol共10对孤对电子对,0.1mol含有NA孤对电子对数,故答案为:NA;
(6)纯叠氮酸(HN3)在常温下是一种液体,沸点较高,为308.8K,主要原因是HN3分子间存在氢键,使沸点反常的升高,故答案为:HN3分子间存在氢键;
(7)以体心Na+研究,与之相邻的Cl-位于面心,晶胞中Na+的配位数为6,晶胞中Na+与Cl-之间的距离为a cm,则晶胞棱长为2a cm,晶胞体积为(2a cm)3,晶胞中Na+离子数目为1+12×$\frac{1}{4}$=4、Cl-离子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,则晶胞质量为4×$\frac{40}{{N}_{A}}$g,则晶胞密度为4×$\frac{40}{{N}_{A}}$g÷(2a cm)3=$\frac{20}{{a}^{3}{N}_{A}}$g.cm-3,
故答案为:6;$\frac{20}{{a}^{3}{N}_{A}}$.
点评 本题考查了核外电子排布式、杂化轨道类型、第一电离能、电负性、分子的极性与非极性、晶胞计算等知识,综合性较强,难度较大.


 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:解答题
| 温度(℃) 气体总浓度 (mol/L) 时间(min) | 15 | 25 | 35 |
| 0 | 0 | 0 | 0 |
| t1 | 9×10-3 | 2.7×10-2 | 8.1×10-2 |
| t2 | 3×10-2 | 4.8×10-2 | 9.4×10-2 |
| t3 | 3×10-2 | 4.8×10-2 | 9.4×10-2 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | B. | C. | D. |
 |  | 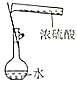 | 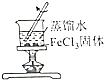 |
| 证明碳的非金属性比硅强 | 探究SO2的漂白性 | 配制一定物质的量浓度的稀硫酸 | 制取少量Fe(OH)3胶体 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 用0.1000mol/L NaOH溶液滴定待测H2SO4溶液:
用0.1000mol/L NaOH溶液滴定待测H2SO4溶液:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
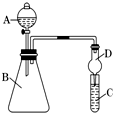 Ⅰ.某同学为探究元素周期表中同周期元素性质的递变规律,设计了如下系列实验.
Ⅰ.某同学为探究元素周期表中同周期元素性质的递变规律,设计了如下系列实验.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
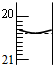
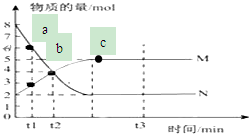 一定温度下,在容积为V L的密闭容器中进行反应:aN(g)?bM(g),M、N的物质的量随时间的变化曲线如图所示:
一定温度下,在容积为V L的密闭容器中进行反应:aN(g)?bM(g),M、N的物质的量随时间的变化曲线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素 | I1 | I2 | I3 | I4 |
| X | 500 | 4 600 | 6 900 | 9 500 |
| Y | 580 | 1 800 | 2 700 | 11 600 |
| A. | 元素X的常见化合价是+1 | |
| B. | 元素Y是ⅢA族元素 | |
| C. | 元素X与氧形成化合物时,化学式可能是X2O或X2O2 | |
| D. | 若元素Y处于第三周期,它可与冷水剧烈反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
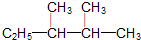 )的系统命名法的名称是2,3-二甲基戊烷;
)的系统命名法的名称是2,3-二甲基戊烷;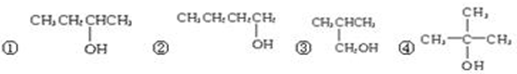
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com