
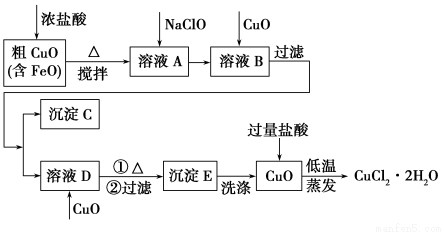
工业上用粗氧化铜(含杂质FeO)为原料制取氯化铜晶体(CuCl2·2H2O)的生产流程如下:
物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
完全沉淀时的pH | ≥9.6 | ≥6.4 | 3~4 |
(1)写出向溶液A中加入NaClO的离子方程式___________________________________。
(2)沉淀C的化学式为________。
(3)实验室如何检验沉淀E已洗涤干净?________。
(4)低温蒸发的目的是______________________________________。
(5)流程中两次加入了CuO,而不是一次性向溶液B中加入过量的CuO,其理由是________________________________________________。
(1)2Fe2++ClO-+2H+=2Fe3++Cl-+H2O
(2)Fe(OH)3
(3)取最后一次洗涤液少量于试管中,加入AgNO3溶液,无白色沉淀生成,说明已洗干净
(4)控制Cu2+水解,防止晶体中结晶水失去(答出一点即可)
(5)一次性加入过量的CuO将导致Fe3+和Cu2+同时生成沉淀
【解析】通过对流程的分析,明确工业生产原理,搞清各步操作的意义。其工业生产原理为:将含杂质的粗氧化铜用盐酸溶解,加入氧化剂NaClO将杂质Fe2+氧化为Fe3+,然后再加入适量氧化铜调节溶液pH,使Fe3+转化为Fe(OH)3沉淀通过过滤而除去;然后再向滤液中加入足量氧化铜调节溶液pH并加热,使Cu2+转化为CuO,最后将CuO溶于盐酸,低温蒸发得到氯化铜晶体。


科目:高中化学 来源:2014年高二鲁科版选修3化学规范训练2.2.1典型分子空间构型练习卷(解析版) 题型:选择题
下列分子的空间构型可用sp2杂化轨道来解释的是( )。
①BF3;②CH2=CH2;③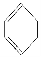 ;④CHCH;⑤NH3;⑥CH4
;④CHCH;⑤NH3;⑥CH4
A.①②③ B.①⑤⑥ C.②③④ D.③⑤⑥
查看答案和解析>>
科目:高中化学 来源:2014年高二鲁科版选修3化学规范训练 2.1.2键参数练习卷(解析版) 题型:填空题
有A、B、C、D、E、F六种元素,已知:
①它们位于三个不同短周期,核电荷数依次增大。
②E元素的电离能数据见下表(kJ·mol-1):
I1 | I2 | I3 | I4 | … |
496 | 4 562 | 6 912 | 9 540 | … |
③B与F同主族。
④A、E分别都能与D按原子个数比1∶1或2∶1形成化合物。
⑤B、C分别都能与D按原子个数比1∶1或1∶2形成化合物。
(1)写出只含有A、B、D、E四种元素的两种无水盐的化学式________________、________________。
(2)B2A2分子中存在________个σ键,________个π键。
查看答案和解析>>
科目:高中化学 来源:2014年高二鲁科版选修3化学规范训练 1.3原子结构与元素性质练习卷(解析版) 题型:选择题
不能说明X的电负性比Y的电负性大的是( )。
A.与H2化合时X单质比Y单质容易
B.X的最高价氧化物的水化物的酸性比Y的最高价氧化物的水化物的酸性强
C.X原子的最外层电子数比Y原子最外层电子数多
D.X单质可以把Y从其氢化物中置换出来
查看答案和解析>>
科目:高中化学 来源:2014年高二鲁科版选修3化学规范训练 1.3原子结构与元素性质练习卷(解析版) 题型:填空题
根据下列五种元素的电离能数据(单位:kJ·mol-1),回答下面问题。
元素代号 | I1 | I2 | I3 | I4 |
Q | 2 080 | 4 000 | 6 100 | 9 400 |
R | 500 | 4 600 | 6 900 | 9 500 |
S | 740 | 1 500 | 7 700 | 10 500 |
T | 580 | 1 800 | 2 700 | 11 600 |
U | 420 | 3 100 | 4 400 | 5 900 |
(1)在周期表中,最可能处于同一族的是( )。
A.Q和R
B.S和T
C.T和U
D.R和T
E.R和U
(2)电解它们的熔融氯化物,阴极电极反应式最可能正确的是( )。
A.Q2++2e-→Q
B.R2++2e-→R
C.S3++3e-→S
D.T3++3e-→T
E.U2++2e-→U
(3)它们的氯化物的化学式,最可能正确的是( )。
A.QCl2
B.RCl
C.SCl3
D.TCl
E.UCl4
(4)下列元素中,化学性质和物理性质最像Q元素的是( )。
A.硼(1s22s22p1)
B.铍(1s22s2)
C.锂1s22s1
D.氢(1s1)
E.氦(1s2)
查看答案和解析>>
科目:高中化学 来源:2014年高二化学苏教版选修2 模块综合检测练习卷(解析版) 题型:选择题
石油裂化的主要目的是为了( )。
A.提高轻质液体燃料的产量
B.便于分馏
C.获得短链不饱和气态烃
D.提高汽油的质量
查看答案和解析>>
科目:高中化学 来源:2014年高二化学苏教版选修2 模块综合检测练习卷(解析版) 题型:选择题
化学在人类生活中扮演着重要角色,以下应用正确的是( )。
A.用浸泡过高锰酸钾溶液的硅土吸收水果释放的乙烯,可达到水果保鲜的目的
B.为改善食物的色、香、味并防止变质,可在其中加入大量食品添加剂
C.使用无磷洗衣粉,可彻底解决水体富营养化问题
D.天然药物无任何毒副作用,可长期服用
查看答案和解析>>
科目:高中化学 来源:2014年高二化学苏教版选修2 6.2绿色化学与可持续发展练习卷(解析版) 题型:填空题
二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。
请回答下列问题:
(1)煤的气化的主要化学反应方程式为:______________________________________。
(2)煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为:____________________________________________________________。
(3)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)  CH3OH(g)ΔH=-90.8 kJ·mol-1
CH3OH(g)ΔH=-90.8 kJ·mol-1
②2CH3OH(g)  CH3OCH3(g)+H2O(g)ΔH=-23.5 kJ·mol-1
CH3OCH3(g)+H2O(g)ΔH=-23.5 kJ·mol-1
③CO(g)+H2O(g)  CO2(g)+H2(g)ΔH=-41.3 kJ·mol-1
CO2(g)+H2(g)ΔH=-41.3 kJ·mol-1
总反应3H2(g)+3CO(g)  CH3OCH3(g)+CO2(g)的ΔH=________;
CH3OCH3(g)+CO2(g)的ΔH=________;
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是________(填字母代号)。
a.高温高压
b.加入催化剂
c.减少CO2的浓度
d.增加CO的浓度
e.分离出二甲醚
(4)已知反应②2CH3OH(g)??CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
浓度/(mol·L-1) | 0.44 | 0.6 | 0.6 |
①比较此时正、逆反应速率的大小:v正________v逆(填“>”、“<”或“=”)。
②若加入CH3OH后,经10 min反应达到平衡,此时c(CH3OH)=________;该时间内反应速率v(CH3OH)=________。
查看答案和解析>>
科目:高中化学 来源:2014年高二化学苏教版选修2 5.2化肥的生产与合理使用练习卷(解析版) 题型:计算题
利用氨氧化法制硝酸,继而制取硝酸铵。若氨氧化法制硝酸的利用率为90%,氨转化为硝酸铵的转化率为94%。则100 t氨最多可生产多少吨硝酸铵?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com