
| A. | 用CO2合成聚碳酸酯等可降解塑料,减少白色污染 | |
| B. | 推广燃煤发电,停建核电站,避免核泄漏事故的危害 | |
| C. | 加强生活污水的脱氮除磷处理,遏制水体的富营养化 | |
| D. | 实施化石燃料脱硫脱硝技术,减少大气污染物的排放 |
分析 A.形成白色污染的主要来源为聚乙烯材料;
B.燃煤发电污染较大;
C.天然水体中由于过量营养物质(主要是指氮、磷等)的排入,引起各种水生生物、植物异常繁殖和生长,这种现象称作水体富营养化;
D.矿物燃料含有硫氮元素.
解答 解:A.形成白色污染的主要来源为聚乙烯材料,难以降解,但利用二氧化碳等原料合成的聚碳酸酯类可降解塑料有利于减少白色污染,故A正确;
B.燃煤发电污染较大,核能是清洁能源,故B错误;
C.大量含有各种含氮和磷有机物的废污水排入水中,促使水域富营养化,加强城市生活污水脱氮除磷处理,可遏制水体富营养化,故C正确;
D.实施矿物燃料脱硫脱硝技术可以减少硫、氮氧化物排放,故D正确.
故选B.
点评 本题考查化学环境污染知识,侧重于化学与生活、生产以及环境的考查,为高考高频考点,有利于培养学生的良好科学素养和学习的积极性,难度不大,注意相关基础知识的积累.


 华东师大版一课一练系列答案
华东师大版一课一练系列答案 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源: 题型:解答题
 学校化学研究小组对某溶液进行检测分析,该无色溶液中可能含有NH4+、K+、Al3+、HCO3-、Cl-、MnO4-、SO42-等离子中的几种离子.
学校化学研究小组对某溶液进行检测分析,该无色溶液中可能含有NH4+、K+、Al3+、HCO3-、Cl-、MnO4-、SO42-等离子中的几种离子.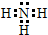 ,空间构型为三角锥形.
,空间构型为三角锥形.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. | 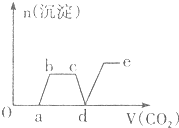 | ||
| C. | 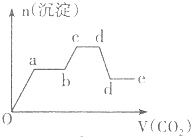 | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向H2SO4溶液中加入Ba(OH)2溶液 | B. | 向AlCl3溶液中通入氨气 | ||
| C. | 向Na2S溶液中通入SO2 | D. | 向Fe2(SO4)3溶液中加入Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O2在①中是氧化剂,在②中是还原剂 | |
| B. | Mn2+在①中是还原产物,在②中是氧化产物 | |
| C. | 在①中每生成1 mol O2,转移的电子数为2.408×1024 | |
| D. | 在二氧化锰催化作用下1 mol H2O2分解生成0.5 mol O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe$\stackrel{盐酸}{→}$FeCl3$\stackrel{Fe}{→}$FeCl2 | |
| B. | Al(OH)3$\stackrel{盐酸}{→}$AlCl3(aq)$\stackrel{蒸发}{→}$无水AlCl3 | |
| C. | NH4Cl(s)$→_{△}^{Ca(OH)_{2}(s)}$NH3$\stackrel{MgCl(aq)}{→}$Mg(OH)2) | |
| D. | C6H5ONa$\stackrel{盐酸}{→}$C6H5OH$\stackrel{Na_{2}CO_{3}(aq)}{→}$CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
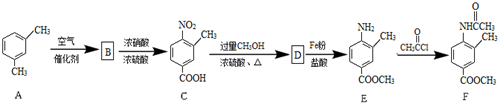
 ;由D→E的反应类型是还原反应.
;由D→E的反应类型是还原反应. .
. .
.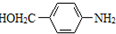 为原料,制备化合物
为原料,制备化合物 的合成路线流程图(无机试剂可任选).合成路线流程图示例如下:H2C=CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH.
的合成路线流程图(无机试剂可任选).合成路线流程图示例如下:H2C=CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| CaCO3 | CaSO4 | Mg(OH)2 | MgCO3 |
| 1.4×10-3 | 2.55×10-2 | 9×10-4 | 1.1×10-2 |
| A. | 硫酸钙悬浊液中存在CaSO4(s)?Ca2+(aq)+SO42-(aq) | |
| B. | 用Na2CO3溶液浸泡锅炉中的水垢,可将水垢中的CaSO4转化为CaCO3 | |
| C. | 向Mg(OH)2悬浊液中滴加FeCl3,沉淀变为红褐色,说明溶解度Fe(OH)3<Mg(OH)2 | |
| D. | 向2ml饱和MgCl2 溶液中先后滴加0.1mol/L的Na2CO3、NaOH溶液各2滴,产生的白色沉淀为Mg(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 平衡后CO的体积分数为40% | B. | 平衡后CO的转化率为25% | ||
| C. | 平衡后水的转化率为50% | D. | 平衡后水的体积分数为30% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com