
硝酸是一种重要的化工原料,主要用于化肥、火药、染料、制药、塑料等产品的生产。
下图为以氨为主要原料制备硝酸的实验装置示意图(夹持装置已经省略)。
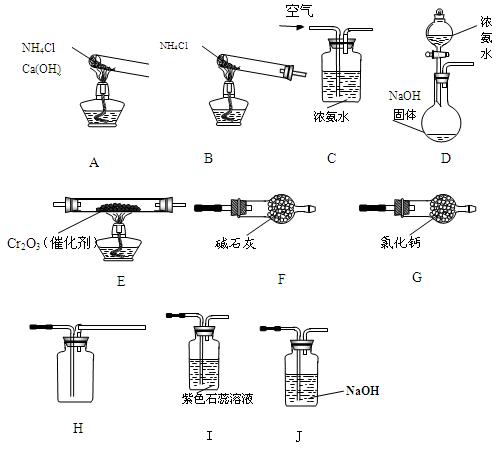
请完成下列问题:
(1)制氨装置最好选择(填相应字母)
(2)写出装置E中发生反应的化学方程式
(3)图中A、B、C、D四种制备氨的方法中不合理的是
(4)装置I、J的作用是 、
(5)你认为本套装置中 (填“是或否”)存在不足?如果你认为存在不足,请提出合理的改进措施
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:阅读理解
 Ⅰ.一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g)
Ⅰ.一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g) FeO(s)+CO(g);△H>0
FeO(s)+CO(g);△H>0| c(CO) | c(CO2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| 加热 |
| ||
| 加热 |
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| △ |
| ||
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
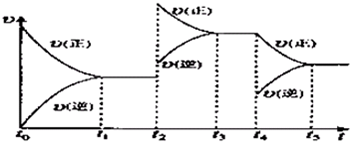
| 15 | 16 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com