
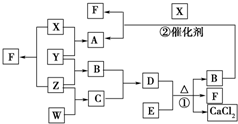
 X、Y、Z、W均为气体单质,A、B、C均为无色气体化合物,D、E均为白色固体,F在通常情况下为无色无味的液体,它们有如下的转化关系:
X、Y、Z、W均为气体单质,A、B、C均为无色气体化合物,D、E均为白色固体,F在通常情况下为无色无味的液体,它们有如下的转化关系: ,F中的化学键类型为共价键.
,F中的化学键类型为共价键.分析 X、Y、Z、W均为气体单质,F在通常情况下为无色无味的液体,X与Z反应得到F,则F为H2O,X、Z分别为H2、O2中的一种,A、B、C均为无色气体化合物,D、E均为白色固体,反应①是实验式制备氨气,则B为NH3,D、E分别为NH4Cl、Ca(OH)2中的一种,B与X反应得到A与F(水),则X为O2,A为NO,Z为H2,X与Y反应得到A,故Y为N2,B(氨气)与C反应得到D,则D为NH4Cl、E为Ca(OH)2、C为HCl,而气体单质W与Z反应得到C,故W为Cl2,据此解答.
解答 解:X、Y、Z、W均为气体单质,F在通常情况下为无色无味的液体,X与Z反应得到F,则F为H2O,X、Z分别为H2、O2中的一种,A、B、C均为无色气体化合物,D、E均为白色固体,反应①是实验式制备氨气,则B为NH3,D、E分别为NH4Cl、Ca(OH)2中的一种,B与X反应得到A与F(水),则X为O2,A为NO,Z为H2,X与Y反应得到A,故Y为N2,B(氨气)与C反应得到D,则D为NH4Cl、E为Ca(OH)2、C为HCl,而气体单质W与Z反应得到C,故W为Cl2.
(1)Y为N2,电子式为 ,F为H2O,含有的化学键类型为共价键,
,F为H2O,含有的化学键类型为共价键,
故答案为: ;共价键;
;共价键;
(2)C的化学式为HCl,故答案为:HCl;
(3)B在F中的反应可以表示为:NH3+H2O?NH3•H2O?NH4++OH-,
故答案为:NH3+H2O?NH3•H2O?NH4++OH-;
(4)反应①的化学方程式:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
点评 本题考查无机物推断,题目涉及物质比较多,熟练掌握气体的实验室制备与常见化学工业、元素化合物性质,题目难度中等.


 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:高中化学 来源: 题型:解答题
| 反应温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| 产品回收率(%) | 75.6 | 78.4 | 80.6 | 82.6 | 83.1 | 82.1 | 73.7 |
| 反应物料比 | 2:1 | 3:1 | 4:1 | 5:1 | 6:1 | 7:1 |
| 产品回收率(%) | 0 | 38.4 | 82. 6 | 83.6 | 84.5 | 84.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
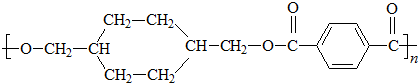
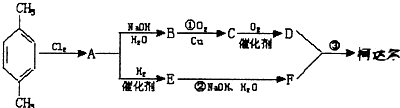
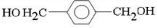 、D
、D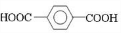 、E
、E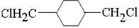 ;
;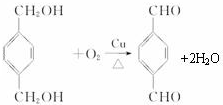
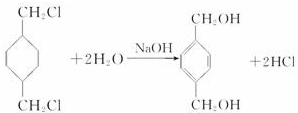 ;
; +
+ $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$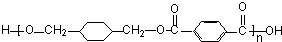 +(2n-1)H2O.
+(2n-1)H2O.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
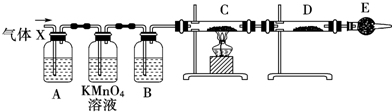
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3、CO、CO2都是极性分子 | |
| B. | CH4、CCl4都是含有极性键的非极性分子 | |
| C. | HF、HCl、HBr、HI的稳定性依次增强 | |
| D. | CS2、H2O、C2H2都是直线形分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
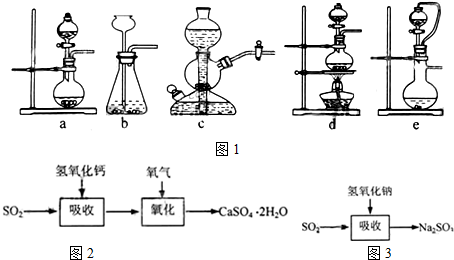
| 试剂 | Ca(OH)2 | NaOH |
| 价格(元/kg) | 0.36 | 2.9 |
| 吸收SO2的成本(元/mol) | 0.027 | 0.232 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾净水与液氯净水的原理相同 | |
| B. | 将草木灰和硫铵混合施用,肥效更高 | |
| C. | 冬季形成的大雾属于气溶胶 | |
| D. | 电解精炼铜时,同一时间内阴极溶解铜的质量比阳极析出铜的质量小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
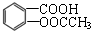 是一种常用的退热、镇痛药物,临床常用于预防心血管疾病.阿斯匹林对肠胃有一定的副作用,患有消化系统疾病的人不宜服用.则下列对此化合物说法不正确的是( )
是一种常用的退热、镇痛药物,临床常用于预防心血管疾病.阿斯匹林对肠胃有一定的副作用,患有消化系统疾病的人不宜服用.则下列对此化合物说法不正确的是( )| A. | 阿斯匹林能与NaHCO3反应,最多能与3mol H2发生加成反应 | |
| B. | 1 mol阿斯匹林与足量的NaOH溶液反应,消耗NaOH最大的物质的量为3 mol | |
| C. | 其苯环上的一氯取代物有两种 | |
| D. | 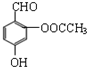 与阿斯匹林互为同分异构体,该有机物遇FeCl3溶液显紫色 与阿斯匹林互为同分异构体,该有机物遇FeCl3溶液显紫色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com