
| A. | 它的名称是2,2-二甲基丁烷 | |
| B. | 它的核磁共振氢谱有3个峰 | |
| C. | 它的分子式为C6H14 | |
| D. | 若它由烯烃与H2加成而来,则烯烃有两种 |
分析 A.该有机物为烷烃,根据烷烃的命名原则对该有机物进行命名;
B.根据有机物分子中含有等效氢原子的数目进行判断;
C.根据结构式确定分子式;
D.该有机物的结构中,只有-CH2CH3中的碳原子之间可以补充双键.
解答 解:A.C(CH3)3CH2CH3分子中,最长碳链含有4个C,主链为丁烷,在2号C上含有2个甲基,该有机物命名为:2,2-二甲基丁烷,故A正确;
B.C(CH3)3CH2CH3分子中,同一个碳原子上的三个甲基等效,亚甲基和另外一个甲基的氢不同,故含有3种氢原子,核磁共振氢谱有3个峰,故B正确;
C.根据结构式确定分子式为C6H14,故C正确;
D.该有机物的结构中,只有-CH2CH3中的碳原子之间可以补充碳碳双键,连接3个甲基上的碳已满足碳的4键,不能再补充双键,则该烯烃有1种,故D错误.
故选D.
点评 本题考查了烷烃的命名、分子式的确定、等效氢的判断等知识,题目难度不大,注意掌握常见有机物的命名原则,明确等效氢的判断方法.


 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:填空题
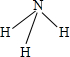 ,它的共价键属于极性(填“极性”或“非极性”)键;含有离子键和非极性共价键的化合物的电子式为
,它的共价键属于极性(填“极性”或“非极性”)键;含有离子键和非极性共价键的化合物的电子式为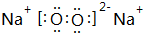 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
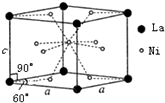 Ni和La的合金是目前使用广泛的储氢材料.该合金的晶胞结构如图所示.
Ni和La的合金是目前使用广泛的储氢材料.该合金的晶胞结构如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学式 | 名称或俗名 | 主要用途 |
| K2FeO4 | 高铁酸钾 | 高能材料、水处理剂和氧化剂 |
| H2C2O4 | 草酸 | 重要还原剂、菠菜成分之一 |
| KAl(SO4)2•12H2O | 明矾 | 净水剂、用于制油条和糕点 |
| Cu2O | 氧化亚铜 | 用于制红色涂料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
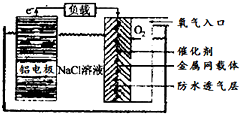 铝是地壳中含量最高的金属元素,其单质、合金及其化合物在生产生活中的应用日趋广泛,铝土矿是生产铝及其化合物的重要原料.
铝是地壳中含量最高的金属元素,其单质、合金及其化合物在生产生活中的应用日趋广泛,铝土矿是生产铝及其化合物的重要原料.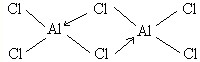 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 组合分类 | 碱 | 酸 | 纯净物 | 碱性氧化物 | 酸性氧化物 |
| A | 烧碱 | H2SO4 | 盐酸 | CaO | SO3 |
| B | 纯碱 | HCl | 冰醋酸 | Na2O2 | CO2 |
| C | NaOH | CH3COOH | 冰水混合物 | Na2O | SO2 |
| D | KOH | HNO3 | 胆矾 | Al2O3 | CO |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
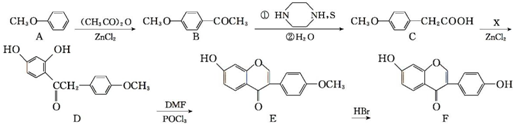
 ,写出该反应的化学方程式
,写出该反应的化学方程式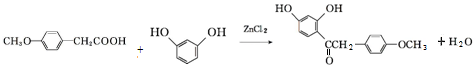 .
.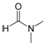 )在POCl3(三氯氧磷)的催化下反应生成E,同时还生成H2O和另一种有机物,写出该有机物的分子式C2H7N.
)在POCl3(三氯氧磷)的催化下反应生成E,同时还生成H2O和另一种有机物,写出该有机物的分子式C2H7N.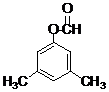 或
或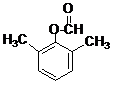 .(写出其中一种的结构简式)
.(写出其中一种的结构简式)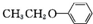 和(CH3CO)2O为原料制备
和(CH3CO)2O为原料制备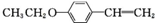 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com