
| 3 |
| 2 |


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
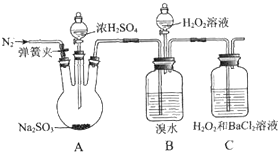 为探究H2O2、SO2、Br2氧化性强弱,某小组同学设计如下实验(夹持及尾气处理装置已略去,气密性已检验).
为探究H2O2、SO2、Br2氧化性强弱,某小组同学设计如下实验(夹持及尾气处理装置已略去,气密性已检验).| 实验操作 | 实验现象 |
| ⅰ.打开A中分液漏斗活塞,滴加浓硫酸 | A中有气泡产生,B中红棕色溴水褪色,C中有白色沉淀 |
| ⅱ.取C中沉淀加入盐酸 | C中白色沉淀不溶解 |
| ⅲ.打开B中分流漏斗活塞,逐滴滴加H2O2 | 开始时颜色无明显变化;继续滴加H2O2溶液,一段时间后,混合液逐渐变成红棕色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=1的溶液中:Na+、Mg2+、SO42-、HCO3- |
| B、含有大量Fe3+的溶液中:Al3+、Cu2+、SO42-、Cl- |
| C、加入A1能放出H2的溶液中:K+、NH4+、NO3-、Cl- |
| D、能使甲基橙呈红色的溶液中:Na+、AlO2-、NO3-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
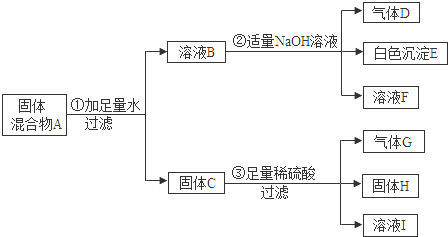
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、萃取操作必须在分液漏斗中进行 |
| B、用酒精灯直接加热蒸馏烧瓶 |
| C、用剩的药品应收集起来放回原试剂瓶中 |
| D、不慎将浓碱溶液沾到皮肤上,要立即用大量水冲洗,然后涂上硼酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、纯碱 | B、白酒 | C、白糖 | D、食醋 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com