
【题目】亚硝酸钠常用作食品防腐剂。现用下图所示仪器(夹持装置已省略)及药品。探究亚硝酸钠与硫酸的反应及生成气体产物的成分。巳知气体液化的温度:NO2:21℃;NO:-152 ℃
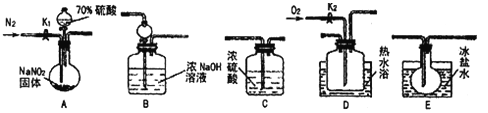
回答下列问题:
(1)为了检验装置A中生成的气体产物,仪器的连接顺序为(按从左到右连接): A→C→___→____→______。
(2)组装好仪器后,接下来进行的操作是____;实验开始时通入N2的作用是______.
(3)关闭弹赞夹K1,打开分液漏斗活塞,滴入70%硫酸后,A中产生红棕色气体。确认A中产生的气体中含有NO,依据的现象是__________;装置E的作用是__________。
(4)根据上述实验,写出该反应的化学方程式:__________。
如果没有装置C,对验证结论造成的影响是__________。
(5)实验结束后还需通入N2的作用是_______;如果向D中通入过量O2,则装置B中发生反应的离子方程式为_____________。
【答案】 E D B 检查装置的气密性 赶走装置的氧气,防止对NO的观察造成影响 D中通氧气后,出现红棕色气体 冷凝使NO2完全液化 2NaNO2+H2SO4(浓)=Na2SO4+NO2↑+NO↑+H2O 水会与NO2反应生成NO,影响后面NO的检验 把装置中的气体全部赶入到B中被吸收,以防止环境污染 4NO2+O2+4OH-=4NO3-+2H2O
【解析】(1)此实验的目的探究亚硝酸钠和硫酸反应以及生成气体的产物,A装置是反应装置,B装置是尾气处理装置,C装置是干燥气体,D装置为验证NO气体,E装置冷却NO2,因此连接顺序是A→C→E→D→B;(2)因为此实验有气体参加,因此实验前,需要检验装置的气密性;装置含有空气,空气中的氧气能氧化NO为NO2,所以实验开始时通入N2的作用是赶走装置的氧气,防止对NO的观察造成影响;(3)NO为无色气体,与氧气生成红棕色气体NO2,因此D装置通入氧气后无色变为红棕色,说明NO的存在;氮的氧化物对环境都是有污染的,必须尾气处理,因此B装置的作用:尾气处理,防止污染空气;NO2的液化温度是21℃,因此E装置的作用:冷凝使NO2完全液化;(4)根据上述实验,该反应的化学方程式为 2NaNO2+H2SO4(浓)=Na2SO4+NO2↑+NO↑+H2O。通入过量O2,NO全部转化成NO2,因此有4NO2+O2+4NaOH=4NaNO3+2H2O,如果没有装置C,水会与NO2反应生成NO,影响后面NO的检查。(5)装置有残留的氮氧化合物,因此实验结束后还需通入N2的作用是把装置中的气体全部赶入到B中被吸收,以防止环境污染;如果向D中通入过量O2,则装置B中发生反应的离子方程式为4NO2+O2+4OH-=4NO3-+2H2O。


科目:高中化学 来源: 题型:
【题目】有一镁、铝合金,在适量稀硫酸中恰好完全溶解,再加入氢氧化钠溶液,析出沉淀的物质的量随氢氧化钠溶液的体积变化如图所示,则合金中镁、铝的物质的量之比为( ) 
A.2:1
B.4:1
C.1:1
D.1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氮及其化合物说法,不正确的是
A.人体中极少量的NO会促进血管扩张,防止血管栓塞
B.光化学烟雾即为含有二氧化氮的有毒烟雾
C.氨水可作化肥
D.工业硝酸常因溶有少量NO2而略显黄色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】前四周期元素A、B、C、D、E、F,原子序数依次递增。已知:A、B、D、C的价电子数依次增多,其中C元素的原子半径最小;A有两个单电子,E的未成对电子数是前四周期中最多的,且其外围电子数与D相同,F的最外层电子数为2,内层全部排满。请用对应的元素符号回答下面的问题:
(1)写出E的价电子排布式:__________________________________________。
(2)在A形成的化合物中,A采取sp2杂化,且分子量最小的化合物为(写化学式)_____________________, 键角约为_____________________________________。
(3)下列物质的性质与氢键有关的是__________________________________________
A. 可燃冰的形成 B. A的氢化物的沸点 C. B的氢化物的热稳定性
(4)E3+可以与AB-形成配离子,其中E3+以d2sp3方式杂化,杂化轨道全部用来与AB-形成配位键,则E3+的配位数为________,1mol该配离子中含有_____________molσ 键。
(5)在C和D形成的化合物中,中心原子没有孤电子对的分子的空间构型为__________。
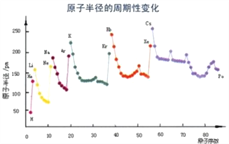
(6)根据下列图片说明为什么同周期过渡金属第一电离能变化没有主族元素变化明显__________________________________________。

(7)F与D形成的化合物晶胞如图,F的配位数为_____________,晶体密度为a g/cm3,NA为阿伏加德罗常数,则晶胞边长为__________________pm。(1pm=10-10cm)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸镁晶须是一种新型吸波隐形材料中的增强剂。某工厂以MgCl2(含少量杂质FeCl2、FeCl3)为原料制备碳酸镁晶须(MgCO3·H2O)的工艺流程如下:

已知:Fe3+、Fe2+、Mg2+生成氢氧化物沉淀时的pH
物质 | 开始沉淀 | 沉淀完全 |
Fe(OH)3 | 2.7 | 3.7 |
Fe(OH)2 | 7.6 | 9.6 |
Mg(OH)2 | 9.9 | 11.1 |
注:Fe(OH)2沉淀呈絮状,不易从溶液中除去。
(1)写出“氧化”过程中发生的离子反应方程式并用单线桥标出电子转移的方向和数目 。
(2)pH调节的范围 ,滤渣的主要成分 (填化学式)。
(3)操作X包括过滤、洗涤、烘干,证明碳酸镁晶须已经洗涤干净的方法 。
(4)水浸后溶液中Fe2+、Fe3+含量的测定
①取水浸后溶液100.00 mL,测得Cl的浓度为0.455 mol·L1,向其中缓缓通入氯气使Fe2+恰好完全转化为Fe3+,测得此时溶液中Cl的浓度为0.460 mol·L1(溶液体积变化忽略不计)。
②另取水浸后溶液100.00 mL,向其中加入过量的1 mol·L1 NaOH溶液,充分反应后过滤、洗涤、灼烧,冷却后,称得固体粉末的质量为0.96 g。
试通过计算确定水浸后溶液中Fe2+、Fe3+的物质的量浓度(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“人文奥运”的一个重要体现是坚决反对运动员服用兴奋剂。某种兴奋剂的结构简式如图所示,下列有关该物质的说法正确的是( )

A. 遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物
B. 该分子中的所有碳原子有可能共平面
C. 1 mol该物质分别与浓溴水和H2反应时,最多消耗Br2和H2分别为4 mol、6 mol
D. 滴入KMnO4酸性溶液,观察到紫色褪去,能证明结构中存在碳碳双键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物A,含有Al2(SO4)3、Al2O3和Fe2O3 , 在一定条件下可实现如图所示的物质之间的变化: 
据此回答下列问题:
(1)Ⅰ、Ⅱ、Ⅲ、Ⅳ四步中对于溶液和沉淀的分离采取的方法是 .
(2)根据上述框图反应关系,写出下列B、E所含物质的化学式 B;E .
(3)写出②、③两个反应方程式 ②;③ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示某种有机物的结构,关于它的性质叙述中正确的是

A. 1mol该有机物在一定条件下,能与7molH2发生加成反应
B. 不能与FeCl3溶液作用发生显色反应
C. 能与NaHCO3反应放出气体
D. 1mol该有机物在一定条件下,能与8molNaOH反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com