
【题目】(1)下列各组物质中:A.O2和O3 B.12C和13C C.H2O和D2O
___组两物质互为同位素;___组两物质互为同素异形体。
(2)工业上用![]() 做原料制取硝酸,要经过三步主要反应,请写出第二步和第三步反应的化学方程式。
做原料制取硝酸,要经过三步主要反应,请写出第二步和第三步反应的化学方程式。
第一步反应:4NH3+5O2![]() 4NO+6H2O
4NO+6H2O
第二步反应:___;
第三步反应:___。
(3)把下列现象中硫酸所表现出来的性质填写在空白处。
用稀硫酸清洗铁锈___;
放置在敞口烧杯中的浓硫酸质量增加__;
浓硫酸滴在纸上时,纸变黑。__;
把铜片放入热的浓硫酸中时,有气体放出。___。
(4)用序号填空,下列物质中:①PH3 ②H2O2 ③Na2O2 ④KOH ⑤(NH4)2SO4 ⑥F2
只含共价键的是___;既含离子键又含极性键的是___;既含离子键又含非极性键的是___。
(5)下列反应中,属于放热反应的有___(填序号)。
①煅烧石灰石(主要成分是CaCO3)制生石灰(CaO)
②Ba(OH)2·8H2O和NH4Cl晶体的反应
③炸药爆炸
④酸与碱的中和反应
⑤生石灰与水作用制熟石灰
⑥食物因氧化而腐败
⑦乙醇燃烧
【答案】B A 2NO+O2=2NO2 3NO2+H2O=2HNO3+NO 酸性 吸水性 脱水性 强氧化性 ①②⑥ ④⑤ ③ ③④⑤⑥⑦
【解析】
(1)A.O2和O3为O元素形成的两种不同种单质,互为同素异形体;
B.12C和13C的质子数相同,而中子数不同,互为同位素;
C.H2O和D2O均是水,属于同一种物质;
故答案为:B;A;
(2)工业上用NH3作原料制取硝酸,整个过程中涉及三个氧化还原反应,①氨气的催化氧化:4NH3+5O2![]() 4NO+6H2O,②NO→NO2,反应方程式为:2NO+O2=2NO2,③NO2和H2O反应生成HNO3和NO,化学反应方程式为3NO2+H2O=2HNO3+NO,故答案为:2NO+O2=2NO2;3NO2+H2O=2HNO3+NO;
4NO+6H2O,②NO→NO2,反应方程式为:2NO+O2=2NO2,③NO2和H2O反应生成HNO3和NO,化学反应方程式为3NO2+H2O=2HNO3+NO,故答案为:2NO+O2=2NO2;3NO2+H2O=2HNO3+NO;
(3)铁锈的主要成分是Fe2O3·xH2O,用稀硫酸清洗铁锈是因为稀硫酸具有酸性,可与金属氧化物发生复分解反应;
由于浓硫酸具有吸水性,因此放置在敞口烧杯中的浓硫酸会吸收空气中的水导致质量增加;
浓硫酸具有脱水性,可使纸中H、O元素以水的形式脱出,留下C元素,从而纸变黑;
浓硫酸具有强氧化性,可与铜片在加热的条件下发生氧化还原反应生成硫酸铜和二氧化硫;
故答案为:酸性;吸水性;脱水性;强氧化性;
(4)①PH3为共价化合物,分子中P原子和H原子形成极性共价键;
②H2O2为共价化合物,分子中H原子和O原子形成极性共价键,O原子和O原子形成非极性共价键;
③Na2O2为离子化合物,Na+和O22-形成离子键,O22-中O原子和O原子形成非极性共价键;
④KOH为离子化合物,K+和OH-形成离子键,OH-中H原子和O原子形成极性共价键;
⑤(NH4)2SO4为离子化合物,NH4+和SO42-形成离子键,NH4+中N原子和H原子形成极性共价键,SO42-中S原子和O原子形成极性共价键;
⑥F2为非金属单质,分子中F原子和F原子形成非极性共价键;
综上,只含共价键的是①②⑥,既含离子键又含极性键的是④⑤,既含离子键又含非极性键的是③,故答案为:①②⑥;④⑤;③;
(5)常见的吸热反应有:大多数的分解反应、碳或氢气作还原剂的氧化还原反应、氢氧化钡与氯化铵的反应等;常见的放热反应有:燃烧反应、中和反应、金属与水或酸的反应、铝热反应等,注意物理变化中也伴随能量变化,如铵盐溶解、浓硫酸稀释等;
①煅烧石灰石(主要成分是CaCO3)制生石灰(CaO)是分解反应,为吸热反应;
②Ba(OH)2·8H2O和NH4Cl晶体的反应,为吸热反应;
③炸药爆炸,为放热反应;
④酸与碱的中和反应,为放热反应;
⑤生石灰与水作用制熟石灰是化合反应,为放热反应;
⑥食物因氧化而腐败是缓慢氧化反应,为放热反应;
⑦乙醇燃烧,为放热反应;
综上所述,属于放热反应的有③④⑤⑥⑦,故答案为:③④⑤⑥⑦。


 优等生题库系列答案
优等生题库系列答案科目:高中化学 来源: 题型:
【题目】维生素C(又名抗坏血酸,分子式为C6H8O6)具有较强的还原性,放置在空气中易被氧化,其含量可用已知浓度的标准I2溶液进行滴定(弱酸性性环境)。该反应的化学方程式为:C6H8O6+I2 = C6H6O6+2HI具体测定步骤及测得数据如下:取10 mL 6 mol·L-1CH3COOH溶液,加入100 mL蒸馏水,将溶液加热煮沸后冷却。精确称取0.2000 g样品,溶解于上述冷却的溶液中,加入1mL指示剂,立即用浓度为0.0500 mol·L-1的标准I2溶液进行滴定到终点,消耗21.00 mL I2溶液。
(1)实验中的指示剂是____________确定达到滴定终点的现象是_____________。
(2)盛装标准I2溶液的是_________(酸式或碱式)滴定管,若滴定结束时俯视滴定管读数(其它操作正确)则滴定结果_______(偏高、偏低或无影响)。
(3)加入的CH3COOH稀溶液要先经煮沸、冷却后才能使用,其目的是_____________。
(4)计算样品中维生素C的质量分数____________(要求列式,且式中各物理量带单位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁氮化合物(FexNy)在磁记录材料领域有着广泛的应用前景。某FexNy的制备需铁、氮气、丙酮和乙醇参与。
(1)Fe3+基态核外电子排布式为___未成对电子数为___个。
(2)丙酮(![]() )分子中碳原子轨道的杂化类型是___,丙酮分子中含有σ键的数目为____个。
)分子中碳原子轨道的杂化类型是___,丙酮分子中含有σ键的数目为____个。
(3)C、H、O三种元素的电负性由小到大的顺序为___。
(4)乙醇的沸点高于丙酮,这是因为___。
(5)利用价层电子对互斥理论判断PCl3的立体构型是___。
(6)某FexNy的晶胞如图-1所示,Cu可以完全替代该晶体中a位置Fe或者b位置Fe,形成Cu替代型产物Fe(x-n) CunNy。FexNy转化为两种Cu替代型产物的能量变化如图-2 所示,其中更活泼的Cu替代型产物的化学式为___。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表标出的是元素周期表的一部分元素,回答下列问题:
A | B | C | |||||||||||||||
D | E | F | G | H | I | J | K | ||||||||||
M |
(1)除稀有气体外第三周期中原子半径最小的是_____(填元素符号)
(2)表中用字母标出的12种元素中,化学性质最不活泼的是_____(用元素符号表示,下同),金属性最强的是___(用元素符号表示),属于过渡元素的是___(该空格用表中的字母表示)
(3)以A的最简单氢化物为燃料,D的最高价氧化物对应水化物为电解质溶液的燃料电池,其负极电极反应式为_____
(4)D、F元素最高价氧化物对应水化物相互反应的离子方程式为_____________
(5)为比较元素A和G的非金属性强弱,用图所示装置进行实验(夹持仪器已略去,装置气密性良好)。溶液B应该选用_____溶液,作用是_________,能说明A和G非金属性强弱的化学方程式是:______________。
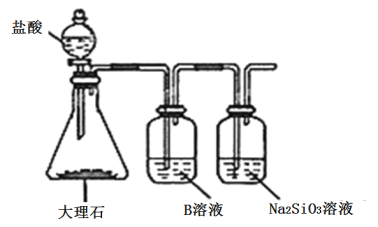
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹,烧杯中的液体呈喷泉状喷出,则a、b不可能是( )
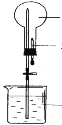
A.a为HCl,b为H2O
B.a为SO2,b为浓NaOH溶液
C.a为NH3,b为稀盐酸
D.a为Cl2,b为饱和NaCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家最近研究出一种环保、安全的储氢方法,其原理可表示为:
NaHCO3+H2![]() HCOONa+H2O下列有关说法正确的是
HCOONa+H2O下列有关说法正确的是
A. 储氢、释氢过程均无能量变化
B. NaHCO3、HCOONa均含有离子键和共价键
C. 储氢过程中,NaHCO3被氧化
D. 释氢过程中,每消耗0.1molH2O放出2.24L的H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有如下两个反应,关于这两个反应的叙述错误的是( )
①2HCl![]() H2↑+Cl2↑ ②2HCl
H2↑+Cl2↑ ②2HCl![]() H2↑+Cl2↑
H2↑+Cl2↑
A.①②两反应都是氧化还原反应
B.①②两反应中的能量转换方式都是热能转变为化学能
C.①反应是热能转变为化学能
D.②反应是电能转变为化学能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物N是制备抗抑郁药物的重要中间体,其一种合成方法如下:

已知:i. ![]() ;
;
ii.  ;
;
iii.R—COOH![]() RCH2OH(R表示烃基)。
RCH2OH(R表示烃基)。
回答下列问题:
(1)A的化学名称为____________,D 中含氧官能团的名称为____________。
(2)C生成D、M生成N的反应类型分别为____________、____________。
(3)B、M的结构简式分别为____________、____________。
(4)写出G生成H的化学方程式:_________________。
(5)芳香族化合物X是E的同分异构体,X能与FeCl3溶液发生显色反应,其核磁共振氢谱显示有4种不同化学环境的氢,且峰面积比为6∶3∶2∶1,写出1种符合要求的X的结构简式:____________。
(6)写出以A和![]() 为原料制备
为原料制备 的合成路线:___________(其他无机试剂任选)。
的合成路线:___________(其他无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在某2 L恒容密闭容器中加入纳米级氧化亚铜并通入0.1 mol 水(g),发生如下反应:2H2O(g)![]() 2H2(g)+O2(g) ΔH=+484 kJ·mol-1。不同时间产生O2的物质的量见下表:
2H2(g)+O2(g) ΔH=+484 kJ·mol-1。不同时间产生O2的物质的量见下表:
时间/min | 20 | 40 | 60 | 80 |
n(O2)/mol | 0.0010 | 0.0016 | 0.0020 | 0.0020 |
下列说法不正确的是( )
A.前20 min内的平均反应速率v(H2O)=5×10-5mol·L-1·min-1
B.达到平衡时,需要从外界吸收的能量为0.968 kJ
C.增大水的浓度,可以改变待反应的限度
D.使用纳米级的氧化亚铜,可以增大平衡时氧气的体积分数
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com