
| 选项 | 有机物 | 同分异构体数目 |
| A | 分子式为C5H12 | 3 |
| B | 分子式为C5H10,能使溴的四氯化碳溶液褪色 | 5 |
| C | 分子式为C5H10O2,能与NaHCO3反应 | 4 |
| D | 分子式为C9H12的芳香族化合物 | 7 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.分子式为C5H12为戊烷,存在三种同分异构体;
B.分子式为C5H10,能使溴的四氯化碳溶液褪色,说明为戊烯,据此解答即可;
C.分子式为C5H10O2,能与NaHCO3反应说明函羧基,同分异构体存在于丁基中;
D.分子式为C9H12的芳香族化合物,含一个苯环,取代基可以是丙基、一个甲基和一个乙基、三个甲基.
解答 解:A.分子式为C5H12为戊烷,同分异构体为正戊烷、异戊烷、新戊烷三种,故A正确;
B.能使溴的四氯化碳溶液褪色,说明为戊烯,分别为1-戊烯、2-戊烯、2-甲基-1-丁烯、2-甲基-2-丁烯、3-甲基-1-丁烯,故总共有5种,故B正确;
C.能与NaHCO3反应说明为羧酸,C5H10O2可写成C4H9COOH,丁基有4种,故C正确;
D.分子式为C9H12的芳香族化合物,含一个苯环,取代基可以是丙基存在两种同分异构体、一个甲基和一个乙基存在邻间对三种同分异构体、三个甲基存在三种同分异构体,共8种,故D错误;
故选D.
点评 本题主要考查的是同分异构体数目的判断,掌握碳原子数小于5的烷烃基的个数是解决本题的关键,题目难度中等,甲基和乙基各1个,丙基2个,丁基4个,戊基8个.


 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:选择题
| A. | 乙烯通入溴水中 | |
| B. | 在镍做催化剂的条件下,苯与氢气反应 | |
| C. | 苯与溴水混合后撒入铁粉 | |
| D. | 光照甲烷与氯气的混合气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 其单体的结构简式为CH2=C(CH3)CH=CH2
其单体的结构简式为CH2=C(CH3)CH=CH2 的名称(系统命名法)2,3-二甲基戊烷
的名称(系统命名法)2,3-二甲基戊烷 (或
(或 或
或 ).
).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 结构简式为  的一溴代物有4种 的一溴代物有4种 | |
| B. | 分子组成是C4H8O2属于酯的同分异构体有6种 | |
| C. | 分子式为C4H8属于烯烃的同分异构体有4种 | |
| D. | C5H12O属于醇的同分异构体有8种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同条件下的沸点:丙三醇>乙二醇>乙醇>乙烷>甲烷 | |
| B. | 将浸透了石蜡油的石棉放在大试管底部,大试管中加入碎瓷片,加强热,将产生的气体持续通入溴的四氯化碳溶液中,红棕色逐渐变浅,最终褪色 | |
| C. | -C3H7和-C2H5O各取代苯分子中的一个氢原子形成的二元取代物的同分异构体有24种 | |
| D. | 薄荷醇 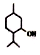 中至少有12个原子共平面 中至少有12个原子共平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应放出a kJ热量 | B. | 消耗1mol N2的同时消耗3molH2 | ||
| C. | 3ν(H2)=2ν(NH3) | D. | N2、H2、NH3的浓度之比为1:3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | 金属钠具有强还原性 | 金属钠可制作高压钠灯 |
| B | Al2O3是两性氧化物 | Al2O3可用作耐火材料 |
| C | 明矾溶于水生成Al(OH)3胶体 | 明矾可作净水剂 |
| D | Fe2O3是碱性氧化物 | Fe2O3可作红色油漆和涂料 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com