
【题目】实验是化学研究的基础。下列关于各实验装置的叙述正确的是
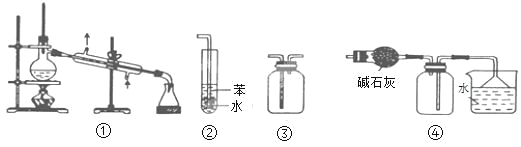
A. 装置③可用于收集H2、CO2、Cl2、NH3等气体
B. 装置②可用于吸收NH3或HCl气体,并防止倒吸
C. 装置①常用于分离互不相溶的液体混合物
D. 装置④可用于干燥、收集氯化氢,并吸收多余的氯化氢
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:
【题目】某有机物X(C13H14O8)分子中含有多种官能团,其结构为 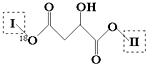 (其中I、II为未知部分的结构):为推测X的分子结构,现进行如图所示的转化.
(其中I、II为未知部分的结构):为推测X的分子结构,现进行如图所示的转化. 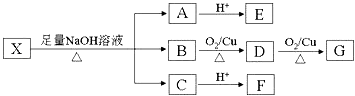
已知:①E分子中检测到18O原子,向E的水溶液中滴入FeCl3溶液显紫色,E的核磁共振氢谱中有4组峰,且峰面积之比为1:2:2:1,E与NaHCO3反应有CO2产生;②G的分子式为C2H2O4 . 请回答下列问题:
(1)E分子所含官能团的名称是;X溶液遇FeCl3溶液不显紫色,则X的结构简式为 .
(2)写出B与G反应生成M(分子内含有六元环)的化学方程式: .
(3)F有特殊愉快的酸味,可作为食品饮料的添加剂;F的聚合物具有良好的生物相容性,可作为手术缝合线等材料广泛应用于生物医药和生物材料领域.由B经过下列途径可合成F: ![]()
已知:RCH2COOH ![]()
![]() ;RCH2Br
;RCH2Br ![]() RCH2COOH
RCH2COOH
①N→T的反应类型是 , N的结构简式是 .
②写出T→F的第一步反应的化学方程式: .
(4)E有多种同分异构体,写出符合下列条件的所有同分异构体的结构简式: .
①属于芳香族化合物;②能发生银镜反应;③苯环上的一氯代物只有2种.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列实验事实:
①![]() 固体既能溶于
固体既能溶于![]() 溶液得到
溶液得到![]() 溶液,又能溶于硫酸得到
溶液,又能溶于硫酸得到![]() 溶液;
溶液;
②向![]() 溶液中滴加
溶液中滴加![]() 溶液,再酸化,可得
溶液,再酸化,可得![]() 溶液;
溶液;
③将![]() 溶液滴加到淀粉和KI的混合溶液中,溶液变蓝。
溶液滴加到淀粉和KI的混合溶液中,溶液变蓝。
下列判断不正确的是
A. 化合物![]() 中
中![]() 元素为+3价
元素为+3价
B. 实验①证明![]() 是两性氧化物
是两性氧化物
C. 实验②证明![]() 既有氧化性又有还原性
既有氧化性又有还原性
D. 实验③证明氧化性: ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是最重要的氮肥,是产量最大的化工产品之一.德国人哈伯在1905年发明了合成氨的方法,其合成原理为:N2(g)+3H2(g)2NH3(g)△H=﹣92.4kJmol﹣1 , 他因此获得了1918年诺贝尔化学奖. 在密闭容器中,使2mol N2和6mol H2混合发生下列反应:N2(g)+3H2(g)2NH3(g)(正反应为放热反应)
(1)当反应达到平衡时,N2和H2的转化率比是 .
(2)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量 ,
密度 . (填“变大”“变小”或“不变”)
(3)当达到平衡时,充入氩气,并保持压强不变,平衡将(填“正向”“逆向”或“不”)移动.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤块的主要成分是MgCl2 , 此外还含Fe2+、Fe3+和Mn2+等杂质离子.以卤块为原料按下图所示流程进行生产,可制得轻质氧化镁. 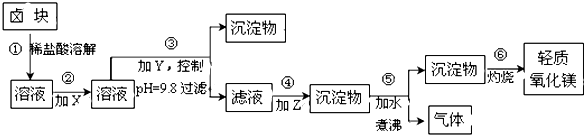
查阅资料得下表相关数据:
表1:生成氢氧化物沉淀的pH | 表2:原料价格表 | |||
物质 | 开始沉淀 | 沉淀完全 | 物质 | 价格(元/吨) |
Fe(OH)3 | 2.7 | 3.7 | a.漂液(含25.2%NaClO) | 450 |
Fe(OH)2 | 7.6 | 9.6﹡ | b.双氧水(含30%H2O2) | 2400 |
Mn(OH)2 | 8.3 | 9.8 | c.烧碱(含98%NaOH) | 2100 |
Mg(OH)2 | 9.6 | 11.1 | d.纯碱(含99.5%Na2CO3) | 600 |
﹡Fe2+氢氧化物呈絮状,不易从溶液中除去,必须将它氧化后以Fe(OH)3沉淀形式才能除尽.
若要求产品尽量不含杂质且生产成本较低,请根据上表提供的资料回答:
(1)流程中加入的试剂X,Y,Z最佳选择依次是表2中的(选填试剂编号).
(2)步骤②发生反应的离子方程式为;步骤⑤中发生反应的化学方程为 .
(3)步骤③控制pH=9.8的目的是 .
(4)若在实验室进行步骤⑥的灼烧实验,必须用到的仪器是铁三脚、酒精喷灯、和泥三角.
(5)在探究Mg(OH)2溶解性的实验中,发现向装有少量Mg(OH)2浊液的试管中加入适量NH4Cl晶体,充分振荡后溶液会变澄清,请用化学平衡的原理解释浊液变澄清的原因 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有①![]() 、
、![]() 、
、![]() ②H2、D2、T2 ③石墨、金刚石④科学家们发现氢元素有三种同位素原子四组微粒或物质,回答下列问题:
②H2、D2、T2 ③石墨、金刚石④科学家们发现氢元素有三种同位素原子四组微粒或物质,回答下列问题:
(1)分别写出氢元素三种同位素的名称:______、_______、______。写出用做制造氢弹原料的同位素原子:______(填原子符号)。
(2)互为同位素的是________(填编号,下同)。
(3)互为同素异形体的是_______。
(4)由①和④中微粒能结合成三原子化合物,写出这些化合物的相对分子质量的最大值和最小值是_____________。
(5)质量相同的H216O 和D216O 所含质子数之比为_______,中子数之比为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学欲探究Na2O2与水的反应,可供使用的试剂有:Na2O2、蒸馏水、KMnO4酸性溶液、MnO2。该同学取4 g Na2O2样品与过量水反应,待完全反应后,得100 mL溶液X和448 mL O2(已折算为标准状况)。该同学推测反应中可能生成了H2O2,并进行实验探究。
⑴试设计实验证明溶液X中含过氧化氢_________________。
⑵通过上述实验证明溶液中确实存在H2O2。取少量X于试管中,滴加几滴酚酞试液,实验现象为___________。
⑶取少量X于试管中,滴加FeCl2溶液,立即生成红褐色沉淀,则该反应的离子方程式为___________。
⑷已知溶液X可使酸性KMnO4溶液褪色,同时放出氧气,完成并配平该反应的离子方程式:____
![]() ________MnO4-+ ________H2O2 + ________H+ — ________Mn2+ + ________O2↑ + __________。
________MnO4-+ ________H2O2 + ________H+ — ________Mn2+ + ________O2↑ + __________。
取100 mL 溶液X,使其与过量酸性KMnO4溶液反应,最终生成224 mL O2(已折算为标准状况),则此样品中Na2O2的质量分数是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在80℃时,将0.40mol的N2O4气体充入2L已经抽空的固定容积的密闭容器中,发生如下反应:N2O42NO2 , 隔一段时间对该容器内的物质进行分析,得到如下数据:
时间/s | 0 | 20 | 40 | 60 | 80 | 100 |
n(N2O4) | 0.40 | a | 0.20 | c | d | e |
n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
(1)计算20~40s内用N2O4表示的平均反应速率为molL﹣1s﹣1 .
(2)计算在80℃时该反应的平衡常数K= .
(3)反应进行至100s后将反应混合物的温度降低,混合气体的颜色(填“变浅”、“变深”或“不变”).
(4)要增大该反应的K值,可采取的措施有(填字母).
a.增大N2O4起始浓度
b.向混合气体中通入NO2
c.使用高效催化剂
d.升高温度.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分离混合物在工业生产中应用广泛.某含有金属钨(W)、WO2、WO3、W2O5的混合物,欲从该混合物中分离出WO3和W2O5,并冶炼金属钨,其流程如图所示.
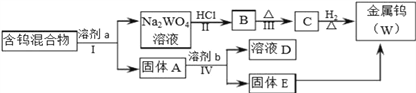
请阅读资料卡片并回答下列问题.
【资料卡片】
i.WO3易溶于NaOH、Na2CO3和Na2C2O4(草酸钠)溶液并形成钨酸盐(Na2WO4);W2O5易被氧化,也能溶解在上述溶液中;金属钨和WO2不溶于上述溶液.
ii.WO3几乎不与无机酸反应.
iii.钨化合物在不同溶剂中的浸取率见下表(浸取是用溶剂溶解固体混合物,以分离可溶性组分及残渣的过程.若浸取率为100%,则固体中的可溶组分全部溶解在溶剂中).
溶剂 | 煮沸时间(min) | W2O5(%) | WO3(%) | WO2 | 金属钨 |
①100g/L NaOH ②300g/LNa2CO3 ③50g/L Na2CO3 ④饱和Na2C2O4 ⑤饱和Na2C2O4(在CO2气氛下浸取) | 25 7 30 60 120 | 72.3 76.4 100 4.2 <0.5 | 100 100 100 100 100 | 未 检 出 | 未 检 出 |
(1)步骤Ⅰ和Ⅳ均要进行的操作是____________________________________________。
(2)WO3既属于金属氧化物,也属于__________(填“酸性”、“碱性”)氧化物,与NaOH溶液反应的离子方程式是__________________________________________________。
(3)步骤Ⅰ是将WO3分离出来,选用的试剂a是⑤,理由是___________________________。
(4)步骤Ⅳ可将W2O5分离出来,选用的试剂b是_______________,固体E中含有的物质是_______________,D中的溶质是_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com