
(1)估计下列各变化过程是熵增还是熵减。
①NH4NO3爆炸:2NH4NO3(s)===2N2(g)+4H2O(g)+O2(g)
②水煤气转化:CO(g)+H2O(g)===CO2(g)+H2(g)
③臭氧的生成:3O2(g)===2O3(g)
(2)可逆反应A(g)+B(g)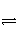
 2C(g)在不同温度下经过一定时间,混合物中C的体积分数与温度的关系如图所示。
2C(g)在不同温度下经过一定时间,混合物中C的体积分数与温度的关系如图所示。
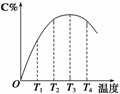
①由T1向T2变化时,正反应速率______逆反应速率(填“>”、“<”或“=”)。
②由T3向T4变化时,正反应速率______逆反应速率(填“>”、“<”或“=”)。
③反应在________温度下达到平衡。
④此反应的正反应为______热反应。
答案 (1)①熵增 ②熵变很小 ③熵减
(2)①> ②< ③T3 ④放
解析 (1)对于有气体参与的化学反应(有气体参与反应时气体既可以是反应物也可以是生成物),气体的物质的量增大的化学反应,其熵变通常是正值,即是熵增大的反应;反之,气体的物质的量减小的化学反应,其熵变通常是负值,即是熵减小的反应。若反应物中气体的物质的量与产物中气体的物质的量相等,其熵变通常都是很小的值,正负由具体的化学反应体系来决定。NH4NO3的爆炸反应是气态物质的物质的量增大的化学反应,(2+4+1)-0>0,因此该过程是熵增的过程。水煤气转化反应,气态物质的物质的量反应前后未发生变化,即(1+1)-(1+1)=0,估计该过程的熵变很小。生成臭氧后,气态物质的物质的量减小,即2-3<0,因此该过程是熵减的过程。
(2)①由T1向T2变化时即温度由T1升高到T2时,C%逐渐增大,说明此时反应未达到平衡,温度升高,使得反应速率加快,而且正反应的反应速率大于逆反应的反应速率,即v正>v逆。
②由T3向T4变化时,C%逐渐减小,说明在温度由T3升高到T4时,反应速率虽然提高,但是正反应的反应速率小于逆反应的反应速率,即v正<v逆,导致C%随温度升高而减小。
③化学反应达到平衡时,正反应的反应速率等于逆反应的反应速率,即v正=v逆,由图示可知反应在T3温度下达到平衡。
④从图中可以看出,随着反应温度的继续升高,C%反而下降,可知正反应是放热反应。


 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案科目:高中化学 来源: 题型:
一个原电池的总反应方程式为Zn+Cu2+===Zn2++Cu,该原电池可能为( )
| A | B | C | D | |
| 正极 | Cu | Al | Zn | Fe |
| 负极 | Zn | Zn | Cu | Zn |
| 电解质溶液 | H2SO4 | CuSO4 | ZnCl2 | CuCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
对可逆反应4NH3(g)+5O2(g)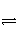
 4NO(g)+6H2O(g),下列叙述正确的是( )
4NO(g)+6H2O(g),下列叙述正确的是( )
A.达到化学平衡时,4v正(O2)=5v逆(NO)
B.若单位时间内生成x mol NO的同时消耗x mol NH3,则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D.化学反应速率关系是:2v正(NH3)=3v正(H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上制备纯硅反应的热化学方程式如下:
SiCl4(g)+2H2(g)===Si(s)+4HCl(g)
ΔH=+Q kJ·mol-1(Q>0)
某温度、压强下,将一定量的反应物通入密闭容器中进行以上反应(此条件下为可逆反应),下列叙述正确的是( )
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1 mol,则达到平衡时,吸收热量为Q kJ
C.反应至4 min时,若HCl浓度为0.12 mol·L-1,则H2的反应速率为0.03 mol·L-1·min-1
D.当反应吸收热量为0.025Q kJ时,生成的HCl通入100 mL 1 mol·L-1的NaOH溶液中恰好反应
查看答案和解析>>
科目:高中化学 来源: 题型:
科学家一直致力于研究常温、常压下“人工固氮”的新方法。曾有实验报道:在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应,生成的主要产物为NH3。进一步研究NH3生成量与温度的关系,部分实验数据见下表(光照、N2、压强1.0×105 Pa、反应时间3 h):
| T/K | 303 | 313 | 323 | 353 |
| NH3生成量 /10-6 mol | 4.8 | 5.9 | 6.0 | 2.0 |
相应的热化学方程式如下:
N2(g)+3H2O(l)===2NH3(g)+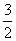 O2(g)
O2(g)
ΔH=+765.2 kJ·mol-1
回答下列问题:
(1)请画出上述反应在有催化剂与无催化剂两种情况下反应过程中体系能量变化的示意图,并进行必要标注。
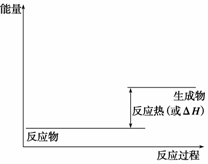
(2)与目前广泛使用的工业合成氨方法相比,该方法固氮反应速率慢。请提出可提高其反应速率且增大NH3生成量的建议:
________________________________________________________________________。
(3)工业合成氨的反应为N2(g)+3H2(g)
 2NH3(g)。设在容积为2.0 L的密闭容器中充入0.60 mol N2(g)和1.60 mol H2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为
2NH3(g)。设在容积为2.0 L的密闭容器中充入0.60 mol N2(g)和1.60 mol H2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为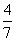 。计算:
。计算:
①该条件下N2的平衡转化率;
②该条件下反应2NH3(g)
 N2(g)+3H2(g)的平衡常数。
N2(g)+3H2(g)的平衡常数。
查看答案和解析>>
科目:高中化学 来源: 题型:
关于元素周期表的下列叙述,错误的是 ( )
A.元素周期表揭示了化学元素的内在联系,是化学发展史上的重要里程碑之一
B.在周期表中,把电子层数相同的元素排成一横行,称为一周期
C.元素周期表中,总共有18个纵行,18个族
D.第IA族的元素又称为碱金属(除了H),第VIIA族的元素又称为卤素
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.元素性质随原子序数的递增呈周期性变化的根本原因是元素化合价呈周期性变化
B.核外电子根据其能量的差别处于不同的电子层,电子能量越高离核越近
C.所有原子的原子核都是由质子和中子构成的
D.在元素周期表中,具有相同电子层数的元素原子所处的周期序数相同
查看答案和解析>>
科目:高中化学 来源: 题型:
某种分子的球棍模型如下图所示(图中球与球之间的连线可代表单键、双键、叁键等):
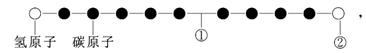
不同形式的球代表不同的原子,对该物质的判断正确的是
A.①处的化学键是碳碳双键 B.②处的原子可能是氯原子
C.该分子中的原子不可能均在同一直线上 D.该分子不存在链状同分异构体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com