
| A. | 0.2 mol•L-1的NaHCO3溶液中:c(Na+)>c(HCO3-)>c(OH-)>c(H+) | |
| B. | 叠氮酸(HN3)与醋酸相似,NaN3水溶液中离子浓度大小为c(Na+)>c(N3-)>c(OH-)>c(H+)[ | |
| C. | 向氨水中逐滴滴入盐酸至溶液的pH=7,则混合液中c(NH4+)=c(Cl-) | |
| D. | 常温下,pH=13的NaOH溶液与pH=1的醋酸溶液等体积混合后所得溶液的pH>7 |
分析 A.碳酸氢根离子部分水解,溶液呈碱性,则c(Na+)>c(HCO3-)、c(OH-)>c(H+);
B.N3-在溶液中部分水解,溶液显示碱性,则c(OH-)>c(H+),根据电荷守恒可知为c(Na+)>c(N3-);
C.溶液的pH=7,为中性溶液,则c(OH-)=c(H+),结合电荷守恒进行判断;
D.醋酸为弱酸,混合液中醋酸过量,反应后的溶液显示酸性.
解答 解:A.0.2 mol•L-1的NaHCO3溶液中,碳酸氢根离子部分水解,溶液呈碱性,则c(Na+)>c(HCO3-)、c(OH-)>c(H+),溶液中离子浓度大小为:c(Na+)>c(HCO3-)>c(OH-)>c(H+),故A正确;
B.叠氮酸(HN3)与醋酸相似,则NaN3水溶液中N3-部分水解,溶液显示碱性,则:c(OH-)>c(H+),根据电荷守恒可知为c(Na+)>c(N3-),离子浓度大小为:c(Na+)>c(N3-)>c(OH-)>c(H+),故B正确;
C.向氨水中逐滴滴入盐酸至溶液的pH=7,则c(OH-)=c(H+),根据电荷守恒可知:c(NH4+)=c(Cl-),故C正确;
D.常温下pH=13的NaOH溶液与pH=1的醋酸溶液等体积混合后,醋酸过量,混合液显示酸性,则所得溶液的pH<7,故D错误;
故选D.
点评 本题考查了离子浓度大小比较,题目难度中等,明确盐的水解原理、电荷守恒等含义为解答关键,试题充分考查了学生的分析、理解能力及灵活应用能力.


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:选择题
| 物质的性质与用途 | 安全常识 | ||
| A | 氮气性质稳定--填充食品袋防腐 乙醇具有可燃性--可用作燃料 一氧化碳具有还原性--可冶炼金属 | B | 假酒中毒--由乙醇引起 瓦斯爆炸--由天然气引起 假盐中毒--由黄曲霉素引起 |
| 元素与人体健康 | 日常生活经验 | ||
| C | 缺铁-易引起贫血 缺钙-易得佝偻病 缺碘-易引起甲状腺肿大. | D | 去除衣服上的油污-用汽油洗涤 区别硬水软水--常用肥皂水检验 使煤燃烧更旺--把煤做成蜂窝状 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质的量就是物质的质量 | |
| B. | 物质的量就是物质的数量 | |
| C. | 物质的量可以改为物质量 | |
| D. | 物质的量就是一个物理量,表示一定微粒数目的集体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
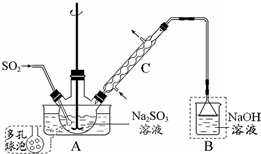 次硫酸氢钠甲醛(NaHSO2•HCHO•2H2O) 俗称吊白块,在印染、医药以及原子能工业中应用广泛.实验室以Na2SO3、SO2、HCHO和锌粉为原料,通过以下反应制得:SO2+Na2SO3+H2O=2NaHSO3
次硫酸氢钠甲醛(NaHSO2•HCHO•2H2O) 俗称吊白块,在印染、医药以及原子能工业中应用广泛.实验室以Na2SO3、SO2、HCHO和锌粉为原料,通过以下反应制得:SO2+Na2SO3+H2O=2NaHSO3查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向无色溶液中滴加氯水和CCl4,振荡静置 | 下层溶液显 紫色 | 原溶液中含有I- |
| B | 过量铁粉加入稀硝酸中充分反应,再加入KSCN溶液 | 溶液呈红色 | 稀硝酸将铁 氧化为Fe2+ |
| C | 向淀粉溶液中滴加稀硫酸,加热,取水解液少许,滴加银氨溶液,并水浴加热 | 没有银镜出现 | 淀粉没有发生水解 |
| D | 用玻璃棒蘸取浓硫酸滴到蓝色石蕊试纸上 | 试纸变黑 | 浓硫酸具有脱水性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 酸 | 电离方程式 | 电离平衡常数K |
| CH3COOH | CH3COOH?CH3COO-+H+ | 1.75×10-5 |
| H2CO3 | H2CO3?H++HCO3- HCO3-?H++CO32- | K1=4.4×10-7 K2=4.7×10-11 |
| H2S | H2S?H++HS- HS-?H++S2- | K1=1.3×10-7 K2=7.1×10-15 |
H3PO4 | H3PO4?H++H2PO4- H2PO4-?H++HPO42- HPO42-?H++PO43- | K1=7.1×10-3 K2=6.3×10-8 K3=4.2×10-13 |
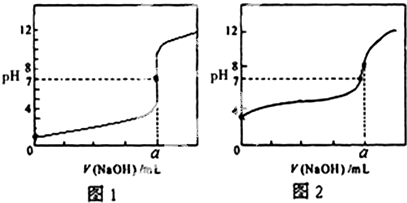
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
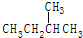
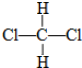 和
和 

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (NH4)2S | B. | NaHSO3 | C. | Al(OH)3 | D. | FeS |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ⑥ | ① | ② | |||||
| 三 | ③ | ④ | ⑤ | ⑪ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com