
【题目】氮化镁(Mg3N2)在工业上应用广泛,通常条件下为黄绿色粉末,极易与水反应,常用作接触媒。
I.氮化镁的制备 下面是甲、乙两位学生提出的制备氮化镁的实验方案示意图(实验前系统内的空气已排除。图中箭头表示气体的流向)。
甲. ![]()
乙. ![]()
(1)Mg3N2的电子式为___________,甲同学的实验方案不能顺利制得氮化镁,原因为________ (用化学方程式表示)。
(2)乙同学方案中NaOH固体的作用为_____________________________________________。
(3)丙同学利用空气中含有大量N2的事实,用以下装置设计了另外一种制备氮化镁的方案 (夹持装置略去):

①按气流由左到右的方向,上述装置合理的连接顺序为____________(填接口字母);
②装置B的作用为___________,装置D的作用为__________________________。
Ⅱ.定性分析产物
操作步明 | 实验现象 | 解释原因 |
取少量产品于试管中,加适量蒸馏水 | 试管底部有固体不溶物,有剌激性气味的气体产生 | (4)反应的化学方程式为___________ |
. | ||
弃去上层淸液,加入足量稀盐酸 | 观察到固体全部溶解,且有气泡冒出 | (5)气泡冒出的原因为_____________ |
Ⅲ.定量测定氮化镁纯度
i.称取4.0 g反应后的固体,加入足量水,将生成的气体全部蒸出并通入100.00mL 1.00 mol/L盐酸中,充分反应后,将所得溶液稀释到200.00mL;
ii.取20.00 mL稀释后的溶液,用0.2 mol/L NaOH标准溶液滴定过量的盐酸,达到终点时消耗标准溶液25.00 mL。
(6)产物中氮化镁的质量分数为_______________。
【答案】 ![]() 2NH3 + H2SO4 = (NH4)2SO4 或NH3 + H2SO4 = NH4HSO4 固体NaOH溶于浓氨水后,放出大量的热,促使NH3的挥发;溶液中OH-浓度的增加,使NH3+H2O
2NH3 + H2SO4 = (NH4)2SO4 或NH3 + H2SO4 = NH4HSO4 固体NaOH溶于浓氨水后,放出大量的热,促使NH3的挥发;溶液中OH-浓度的增加,使NH3+H2O![]() NH3·H2O
NH3·H2O![]() NH4++OH-向生成NH3的方向移动 i-g-h-a-b-e-f-d-c 防止外界空气进入装置C使Mg3N2变质 吸收空气中的CO2和H2O,防止与镁反应 Mg3N2+6H2O=3Mg(OH)2+2NH3↑ 未反应的镁与盐酸反应产生氢气 62.5%
NH4++OH-向生成NH3的方向移动 i-g-h-a-b-e-f-d-c 防止外界空气进入装置C使Mg3N2变质 吸收空气中的CO2和H2O,防止与镁反应 Mg3N2+6H2O=3Mg(OH)2+2NH3↑ 未反应的镁与盐酸反应产生氢气 62.5%
【解析】(1)氮化镁(Mg3N2)是离子化合物,则其电子式为:![]() ;甲同学的实验方案中制得的氨气用浓硫酸进行干燥,会发生反应:2NH3 + H2SO4 = (NH4)2SO4 或NH3 + H2SO4 = NH4HSO4,则后面不能顺利制得氮化镁;(2)乙同学方案中利用NaOH固体与浓氨水作用制取氨气,NaOH固体的作用为固体NaOH溶于浓氨水后,放出大量的热,促使NH3的挥发;溶液中OH-浓度的增加,使NH3+H2O
;甲同学的实验方案中制得的氨气用浓硫酸进行干燥,会发生反应:2NH3 + H2SO4 = (NH4)2SO4 或NH3 + H2SO4 = NH4HSO4,则后面不能顺利制得氮化镁;(2)乙同学方案中利用NaOH固体与浓氨水作用制取氨气,NaOH固体的作用为固体NaOH溶于浓氨水后,放出大量的热,促使NH3的挥发;溶液中OH-浓度的增加,使NH3+H2O![]() NH3·H2O
NH3·H2O![]() NH4++OH-向生成NH3的方向移动,从而得到氨气;(3)①根据图中给出装置,制备氮化镁的方案:E装置利用水将集气瓶中的空气排入到D装置干燥和收空CO2后,气体在A装置中除氧气,剩下主要成分为氮气进行C装置与镁反应,最后用B装置防止空气进入装置C,按气流由左到右的方向,上述装置合理的连接顺序为i-g-h-a-b-e-f-d-c;②装置B的作用为防止外界空气进入装置C使Mg3N2变质;装置D的作用为吸收空气中的CO2和H2O,防止与镁反应;(4)产品氮化镁与水反应生成氢氧化镁和氨气,反应的化学方程式为:Mg3N2+6H2O=3Mg(OH)2+2NH3↑;(5)试管底部有固体不溶物,弃去上层淸液,加入足量稀盐酸,观察到固体全部溶解,且有气泡冒出,是因为未反应的镁与盐酸反应产生氢气;(6)20.00 mL稀释后的溶液,消耗 NaOH的物质的量为:0.2 mol/L×0.025L=0.005mol,则200.00mL溶液消耗NaOH的物质的量为: 0.05mol,故产生的氨气的物质的量为n(HCl)-n(NaOH)=0.1L×1.00mol/L-0.05mol=0.05mol,根据反应Mg3N2+6H2O=3Mg(OH)2+2NH3↑,设产物中氮化镁的质量分数为x,则有
NH4++OH-向生成NH3的方向移动,从而得到氨气;(3)①根据图中给出装置,制备氮化镁的方案:E装置利用水将集气瓶中的空气排入到D装置干燥和收空CO2后,气体在A装置中除氧气,剩下主要成分为氮气进行C装置与镁反应,最后用B装置防止空气进入装置C,按气流由左到右的方向,上述装置合理的连接顺序为i-g-h-a-b-e-f-d-c;②装置B的作用为防止外界空气进入装置C使Mg3N2变质;装置D的作用为吸收空气中的CO2和H2O,防止与镁反应;(4)产品氮化镁与水反应生成氢氧化镁和氨气,反应的化学方程式为:Mg3N2+6H2O=3Mg(OH)2+2NH3↑;(5)试管底部有固体不溶物,弃去上层淸液,加入足量稀盐酸,观察到固体全部溶解,且有气泡冒出,是因为未反应的镁与盐酸反应产生氢气;(6)20.00 mL稀释后的溶液,消耗 NaOH的物质的量为:0.2 mol/L×0.025L=0.005mol,则200.00mL溶液消耗NaOH的物质的量为: 0.05mol,故产生的氨气的物质的量为n(HCl)-n(NaOH)=0.1L×1.00mol/L-0.05mol=0.05mol,根据反应Mg3N2+6H2O=3Mg(OH)2+2NH3↑,设产物中氮化镁的质量分数为x,则有![]() =
=![]() ,解得x= 62.5%。
,解得x= 62.5%。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知,某温度时CH3COOH的电离平衡常数为K。该温度下向20 mL0.1mol/L CH3COOH溶液中逐滴加入0.1 mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化)。下列说法正确的是
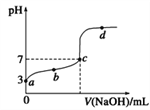
A. a点表示溶液中c(CH3COO-)约为10-3 mol/L
B. b点表示的溶液中c(CH3COO-)< c(Na+)
C. c点表示CH3COOH和NaOH恰好反应完全
D. b、d点表示的溶液中 的值不相等
的值不相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海带中制取单质碘需要经过灼烧、溶解、过滤、氧化、萃取、分液、蒸馏等操作.下列图示对应的装置合理、操作规范的是( )
A. 灼烧
灼烧
B. 过滤
过滤
C. 分液
分液
D. 蒸馏
蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
A. 用燃着的酒精灯去点燃另一个酒精灯
B. 用托盘天平称量固体的质量时,砝码放在右盘
C. 给试管里的固体加热时,试管口略向下倾斜
D. 给烧瓶里的液体加热时,垫上石棉网
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、R为五种短周期元素,其原子半径和最外层电子数之间的关系如图所示。下列说法不正确的是( )

A. 简单离子半径:M<R
B. 氢化物的稳定性:Y<Z
C. M的氢化物常温常压下为气体
D. X、R、Y、Z均存在两种及两种以上的氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对化学平衡移动的分析中,不正确的是( )
①已达平衡的反应C(s)+H2O(g)![]() CO(g)+H2(g),当增加反应物物质的量时,则平衡向正反应方向移动;
CO(g)+H2(g),当增加反应物物质的量时,则平衡向正反应方向移动;
②已达平衡的反应N2(g)+3H2(g)![]() 2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率升高;
2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率升高;
③有气体参加的反应平衡时,若减小反应器容积时,平衡一定向气体总物质的量增大的方向移动;
④有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡一定不移动.
A. ①④ B. ①②③ C. ②③④ D. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】国际能源网报道:金属燃料可能成为新能源,可能带来结束化石能源时代的希望,是一种理想的储能方式。下列说法不正确的是( )
A.钠米金属燃料,更易点燃
B.铁作燃料时,可用磁性材料吸引生成物,便于产物分离
C.镁可以通过2Mg+CO2=2MgO+C,达到既节能减碳又释放能量的效果
D.可从海水中提取氯化镁,并使氯化镁分解获得镁并释放出能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生欲用12molL﹣1浓盐酸和蒸馏水配制500mL物质的量浓度为0.3molL﹣1的稀盐酸. ①该学生需要量取mL上述浓盐酸进行配制.
②配制过程中正确的操作顺序是(字母表示,每个字母只能用一次);
A.用少量水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取所需浓盐酸,沿玻璃棒倒入烧杯中,再加入少量水,用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入500mL容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1~2cm处
③下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(在括号内填“偏大”、“偏小”、“无影响”).
a.用量筒量取浓盐酸时俯视观察凹液面
b.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水
c.稀释浓盐酸时,未冷却到室温即转移到容量瓶中
d.将量取浓盐酸的量筒进行洗涤,并将洗涤液转移到容量瓶中
e.容量瓶洗涤干净后未干燥
④若在标准状况下,将V LHCl气溶解在1L水中(水的密度近似为1g/mL),所得溶液的密度为ρ g/mL,则此溶液中HCl物质的量浓度为
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com