
���� �ټ״��������Լ�ǿ�����������Һ�������ֻ���أ��ŵ�ʱ������ӦΪ��CH3OH-6e-+8OH-=CO32-+6H2O�������缫��Ӧʽ��O2+2H2O+4e-=4OH-����ط�ӦΪ2CH3OH+3O2+4OH-=2CO32-+6H2O��
�ڵ������и���ת�Ƶ�������ȼ��䷽��ʽ���㣮
��� �⣺�ٷŵ�����У��״���ȫ����������CO2�������������CO32-����Ӧ���ܷ���ʽΪ2CH3OH+3O2+4OH-=2CO32-+6H2O��
�ʴ�Ϊ��2CH3OH+3O2+4OH-=2CO32-+6H2O��
�ڷŵ�ʱ���״���������ӦΪ��ظ�����Ӧ���ɸ�����ӦΪ��CH3OH-6e-+8OH-=CO32-+6H2O��n��CH3OH��=$\frac{16}{32}$=0.5mol��ת�Ƶ��ӵ����ʵ���Ϊ0.5mol��6=3mol��
2CuSO4+2H2O$\frac{\underline{\;���\;}}{\;}$2Cu+O2��+2H2SO4ת�Ƶ���
22.4L 4mol
x 3mol��80%
x=13.44L��
�ʴ�Ϊ��13.44��
���� �����ۺϿ���ԭ��ع���ԭ������Ŀ�Ѷ��еȣ�ע����������Ϣ��ȷ��д�缫����ʽΪ������Ĺؼ�������ʱע��������ת�Ƶ�������ȼ��㣮


 ��һ������ĩ�ٷֳ�̾�ϵ�д�
��һ������ĩ�ٷֳ�̾�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
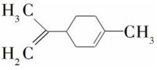
| A�� | ����ϩ��һ�ȴ�����7�� | |
| B�� | ����ϩ�Ͷ�������Ϊͬ���칹�� | |
| C�� | ����ϩ�ķ��������е�̼ԭ�ӿ�����ͬһ��ƽ���� | |
| D�� | ��һ�������£�����ϩ���Է����ӳɡ�ȡ������������ԭ�ȷ�Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢� | B�� | �ڢ� | C�� | �ڢۢ� | D�� | �ۢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Ԫ�طǽ�����������ǿ��˳��ΪZ��Y��X | |
| B�� | ������YZ2�и�ԭ�Ӷ��ﵽ8���ӽṹ | |
| C�� | ��3��Ԫ�ص��⻯��ķе��ɸߵ��͵�˳��Ϊ��Z��Y��X | |
| D�� | ���Ӧ�������Ӱ뾶�ɴ�С��˳��Ϊ��Z��Y��X |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 0.1mol/L��Na2CO3��Һ�У�c��CO32-���T2c��HCO3-��+c��H+��-c��OH-�� | |
| B�� | ���ʵ���Ũ��֮��Ϊ1��2��NaClO��NaHCO3�����Һ�У�c��HClO��+c��ClO-��=2c��HCO3-��+2c��CO32-��+2c��H2CO3�� | |
| C�� | ��3.0L0.1mol/LNaOH��Һ�л���ͨ��CO2����Һ����8.8gʱ����Һ�У�c��Na+����c��CO32-����c��HCO3-����c��OH-����c��H+�� | |
| D�� | �����ʵ�����CH3COOH��CH3COONa�����ҺPH=4.75�У�c��CH3COO-��+c��OH-����c��CH3COOH��+c��H+�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ڢ� | B�� | �٢ۢ� | C�� | �ڢۢ� | D�� | �٢� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������ӦʽΪ��O2+2H2O+4e-�T4OH- | |
| B�� | ����һ��ʱ��������Һ��KOH�����ʵ������� | |
| C�� | ��ȼ�ϵ�ص��ܷ�ӦʽΪ��2H2+O2�T2H2O | |
| D�� | �õ�ع���ʱÿ����1molO2����2mol����ת�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���

�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com