
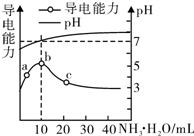
| A. | HR为强酸 | |
| B. | b点溶液呈中性,说明NH4R没有水解 | |
| C. | c点溶液存在c(NH4+)<c( R-) | |
| D. | b~c任意点溶液均有c(H+)×c(OH-)=l.0×l0-14 |
分析 A.根据图知,10mL时混合溶液中酸碱的物质的量相等,二者恰好完全反应生成NH4R,溶液呈中性,且一水合氨是弱碱,则该铵盐是弱酸弱碱盐;
B.b点溶液呈中性,NH4R为弱酸弱碱盐,含有弱离子的盐能水解;
C.c点溶液呈碱性,结合电荷守恒判断铵根离子和酸根离子浓度相对大小;
D.离子积常数只与温度有关,温度不变,则离子积常数不变.
解答 解:A.根据图知,10mL时混合溶液中酸碱的物质的量相等,二者恰好完全反应生成NH4R,溶液呈中性,且一水合氨是弱碱,则该铵盐是弱酸弱碱盐,则HR是弱酸,故A错误;
B.b点溶液呈中性,NH4R为弱酸弱碱盐,含有弱离子的盐能水解,所以该盐能水解,且酸根离子和铵根离子水解程度相等,故B错误;
C.c点溶液呈碱性,则溶液中存在c(H+)<c(OH-),结合电荷守恒得c(NH4+)>c( R-),故C错误;
D.离子积常数只与温度有关,温度不变,则离子积常数不变,所以温度不变b~c任意点溶液均有c(H+)×c(OH-)=l.0×l0-14,故D正确;
故选D.
点评 本题考查酸碱混合溶液定性判断,为高频考点,侧重考查学生图象分析判断能力,正确判断HR酸性强弱是解本题关键,注意C中c点溶液呈碱性而不是酸性,为易错点.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 化学反应速率是指一定时间内任何一种反应物浓度的减少或者任何一种生成物浓度的增加 | |
| B. | 化学反应速率为“0.8 mol/(L•s)”表示的意思是:时间为1 s时,某物质的浓度为0.8 mol/L | |
| C. | 对于任何化学反应来说,反应速率越大,反应现象越明显 | |
| D. | 根据化学反应速率的大小可以知道化学反应进行的快慢 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 实验操作 | 实验目的 |
| A | Cl2、Br2分别与H2反应 | 比较氯、溴的非金属性强弱 |
| B | 向MgCl2、AlCl3溶液中分别通入NH3 | 比较镁、铝金属性强弱 |
| C | 测定相同物质的量浓度的Na2CO3、Na2SO4溶液的pH | 比较碳、硫的非金属性强弱 |
| D | Fe、Cu分别与稀盐酸反应 | 比较铁、铜的金属性强弱 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.8g | B. | 4.4g | C. | 8.8g | D. | 4.4~8.8g |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com