
| A. | 氢氧化钠能与盐酸反应,可用作治疗胃酸过多的药剂 | |
| B. | 氧化铝具有很高的熔点,可制耐高温耐火材料 | |
| C. | 常温下,浓硝酸不跟铁发生化学反应,可用铁制容器盛装浓硝酸 | |
| D. | 钠具有极强的还原性,可用钠与CuCl2溶液反应制取铜 |
分析 A.氢氧化钠具有强腐蚀性;
B.高熔点的物质能作耐高温耐火材料;
C.常温下,浓硝酸和铁发生钝化现象;
D.钠投入盐溶液中时,先和水反应生成NaOH和氢气.
解答 解:A.虽然氢氧化钠具有碱性,但氢氧化钠具有强腐蚀性,所以不能做治疗胃酸过多的药剂,可以用碳酸氢钠做治疗胃酸过多的药剂,故A错误;
B.高熔点的物质能作耐高温耐火材料,氧化铝熔沸点较高,所以可以做耐高温耐火材料,故B正确;
C.常温下,浓硝酸和铁发生氧化还原反应生成一层致密的氧化物薄膜而阻止进一步被氧化,该现象是钝化现象,所以常温下,可以用铁制容器盛装浓硝酸,故C错误;
D.钠投入盐溶液中时,先和水反应生成NaOH和氢气,生成的NaOH再和氯化铜发生复分解反应生成氢氧化铜,所以不能置换出Cu,故D错误;
故选B.
点评 本题考查元素化合物性质及用途,明确物质性质是解本题关键,注意:钝化现象不是不反应,D中反应先后顺序,这些都是易错点.


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:解答题

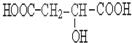 请回答:
请回答: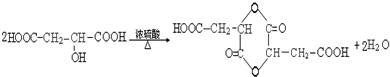 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
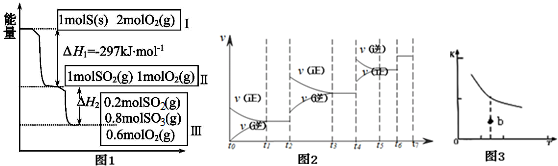
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
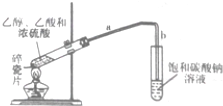 合成乙酸乙酯的路线如下:
合成乙酸乙酯的路线如下: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只含有Fe2+、Cu2+、Cl- | |
| B. | c(Fe2-):c(Cu2+)=1:2 | |
| C. | c(Cl-)=6.0mol.L-1,c(Fe2+)=1.2mol.L-1 | |
| D. | c(Fe2+):c(Fe3+)=3:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实验 混合溶液 | A | B | C | D | E | F |
| 4mol•L-1 H2SO4/mL-1 | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL-1 | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL-1 | V7 | V8 | V9 | V10 | 10 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾[KAl(SO4)2•12H2O]在水中能形成Al(OH)3胶体,可用作净水剂 | |
| B. | 向50mL 18mol/L 硫酸中加入足量铜片并加热,被还原硫酸的物质的量是0.45mol | |
| C. | 浓硫酸溅到皮肤上,立即用碳酸钠稀溶液冲洗 | |
| D. | 将SO2通入品红溶液,溶液褪色后加热恢复原色;将SO2通入溴水,溴水色后加热也能恢复原色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com