
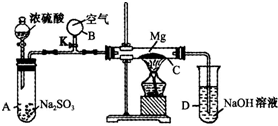
 按如图装置进行如下实验,请用你所学知识完成下题:
按如图装置进行如下实验,请用你所学知识完成下题:分析 浓硫酸和亚硫酸钠反应生成二氧化硫气体,Mg与SO2在加热的条件下能够发生化学反应生成淡黄色固体S,臭鸡蛋气味的气体为硫化氢,因此二氧化硫与Mg反应产物为MgS、S.根据元素守恒可知,另外一种产物为氧化镁,打开K,将空气充入反应反应体系,可平衡容器内外压强,防止倒吸.
解答 解:(1)停止实验后,温度降低导致体系内部压强减小,容易发生倒吸,打开K,将空气充入反应反应体系,可平衡容器内外压强,防止倒吸,
故答案为:防止C降温时因C中气体压强减小而引起D中溶液的倒吸;
(2)浓硫酸和亚硫酸钠反应生成二氧化硫气体,二氧化硫与Mg反应,生成淡黄色固体S,臭鸡蛋气味的气体为硫化氢,因此二氧化硫与Mg反应产物为MgS.根据元素守恒可知,另外一种产物为氧化镁,
故答案为:MgO;MgS; S.
点评 本题考查了物质实验室制备原理和装置选择,实验步骤的设计分析判断,物质性质的应用是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
 下列各组物质中,满足下图物质一步转化关系的选项是( )
下列各组物质中,满足下图物质一步转化关系的选项是( )| X | Y | Z | |
| A | Na | NaOH | NaHCO3 |
| B | S | SO3 | SO2 |
| C | Cu | CuO | CuSO4 |
| D | Si | SiO2 | H2SiO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3. | 溶解性 |
| 乙二醇(C2H6O2) | -11.5 | 198 | 1.11 | 与水和酒精等混溶 |
| 丙三醇(C3H8O3) | 17.9 | 290 | 1.26 | 与水和酒精等混溶 |
| A. | 蒸馏法 | B. | 萃取法 | ||
| C. | “溶解、结晶、过滤”的方法 | D. | 分液法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2、NO2、粉尘、煤烟 | B. | CO2、O2、氮的氧化物、碳氢化合物 | ||
| C. | Cl2、N2、煤烟、氮的氧化物 | D. | H2S、SO2、粉尘、煤烟、氮的氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑥ | ⑦ | ||||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ | ⑨ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com