
【题目】某化学兴趣小组要完成中和热的测定。
(1)实验桌上备有烧杯(大、小两个烧杯)、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃棒、0.5mol·L-1 盐酸、0.55mol·L-1NaOH溶液,尚缺少的实验玻璃用品是______,______。
(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒?为什么?__________。
(3)他们记录的实验数据如下:已知:![]()
①计算完成下表。(保留小数点后一位)
序号 | 实验用品 | 溶液温度 | 温度差平均值 | ||
t 1 | t 2 | ||||
1 | 50 mL0.55mol·LNaOH | 50 mL0.5mol·LHCl | 20℃ | 23.3℃ | _____ |
2 | 50 mL0.55mol·LNaOH | 50 mL0.5mol·LHCl | 20℃ | 23.5℃ | |
②根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式:______________。
(4)若用KOH代替NaOH,对测定结果________(填“有”或“无”)影响;若用醋酸代替HCl做实验,测定所得的中和热的数值将________(填“变大”或“变小”或“无影响”)。
【答案】量筒 温度计 否,金属易导热,热量散失导致误差大 3.4℃ NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) △H=-56.8kJ/mol 无 变小
【解析】
(1)根据各仪器的作用,结合中和热实验原理来选取仪器;
(2)金属导热快,热量损失多;
(3)先判断温度差的有效性,然后求出温度差平均值,再根据△H=-![]() kJ/mol计算出反应热,根据中和热的概念以及热化学方程式的书写方法写出热化学方程式;
kJ/mol计算出反应热,根据中和热的概念以及热化学方程式的书写方法写出热化学方程式;
(4)根据中和热的概念分析,弱电解质电离吸热。
(1)测定稀盐酸和稀氢氧化钠的中和热,所需要的玻璃仪器有:大、小两个烧杯、胶头滴管、量筒、温度计以及环形玻璃搅拌器,需要用量筒量取酸溶液、碱溶液的体积,需要使用温度计测量温度,所以还缺少量筒和温度计;
(2)不能用环形铜丝搅拌棒代替环形玻璃搅拌棒,因为铜丝搅拌棒是热的良导体,热量损失大,导致误差大;
(3)2次温度差分别为:3.3℃,3.5℃,2组数据都有效,温度差平均值=3.4℃;50mL0.55mol/LNaOH和50mL0.5mol/LHCl质量和为m=100mL×1g/mL=100g,c=4.18J/(g℃),△T=3.4℃,代入公式Q=cm△T得生成0.025mol的水放出热量Q=4.18J/(g℃)×100g×3.4℃=1421.2J=1.4212kJ,即生成0.025mol的水放出热量1.4212kJ,所以生成1mol的水放出热量为Q=![]() =56.8kJ,即该实验测得的中和热△H=-56.8kJ/mol,NaOH溶液与HCl溶液反应的热化学方程式为:NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) △H=-56.8kJ/mol;
=56.8kJ,即该实验测得的中和热△H=-56.8kJ/mol,NaOH溶液与HCl溶液反应的热化学方程式为:NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) △H=-56.8kJ/mol;
(4)在稀溶液中,酸跟碱发生中和反应生成1mol水时的反应热叫做中和热,若用KOH代替NaOH,由于KOH、NaOH都是一元强碱,在溶液中都是以离子形式存在,因此对测定结果无影响;醋酸为弱酸,主要以电解质分子存在,存在电离平衡,醋酸的电离过程为吸热过程,所以用醋酸代替HCl做实验,反应放出的热量小于56.8kJ,导致测定结果偏小,对测定结果有影响。


 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案科目:高中化学 来源: 题型:
【题目】美国计划2020年再次登陆月球,并在月球上建立永久性基地,为人类登陆新的行星做好前期准备。为了解决基地人员的供氧问题,科学家设想利用月球富氧岩石制取氧气。其提氧原理是用氢气还原富氧岩石获取水,再利用太阳能电池电解水得到氢气和氧气。
玄武岩(含钛铁矿)是月球的主要岩石之一,其质地坚硬,钛铁矿的主要成分为钛酸亚铁(![]() )。用上述提氧原理,理论上,从1 kg
)。用上述提氧原理,理论上,从1 kg ![]() 中可获取105.3g
中可获取105.3g ![]() 。
。
(1)写出![]() 与
与![]() 反应的化学方程式:______________________________________________。
反应的化学方程式:______________________________________________。
(2)研究表明,月球上平均直径为40微米的小圆珠形成的堆积物(富含![]() )是最适合提氧的矿物。这种堆积物作为提氧原料的优点是____________________________________________________________。
)是最适合提氧的矿物。这种堆积物作为提氧原料的优点是____________________________________________________________。
(3)研究人员查阅文献后,得知钛铁矿在高温下还能被炭粉还原: ,
,![]() 通过植物的光合作用可获得
通过植物的光合作用可获得![]() ,化光学方程式为
,化光学方程式为![]() (葡萄糖)
(葡萄糖)![]() 。他们设计了两套实验装置来测定钛铁矿中可提取氧的质量分数。
。他们设计了两套实验装置来测定钛铁矿中可提取氧的质量分数。

研究人员用图1装置从钛铁矿中提取氧,实验中得出的可提取氧的质量分数大于理论值,产生这种情况的原因可能是______________________;用图2装置进行实验的过程中,称得反应前钛铁矿的质量为![]() ,炭粉的质量为
,炭粉的质量为![]() ,钛铁矿完全反应后,测得生成
,钛铁矿完全反应后,测得生成![]() 的质量为
的质量为![]() ,则钛铁矿中可提取氧的质量分数为________________。
,则钛铁矿中可提取氧的质量分数为________________。
(4)在钛铁矿提氧过程中科学家们常选用![]() 而不用其他还原剂,其主要原因是______________________。
而不用其他还原剂,其主要原因是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了在实验室利用工业原料制备少量氨气,有人设计了如图所示的装置(图中夹持装置均已去)。
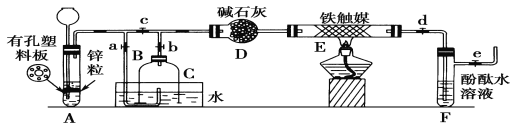
实验操作:
①检查实验装置的气密性后,关闭弹簧夹a、b、c、d、e。在A中加入锌粒,向长颈漏斗中注入一定量稀硫酸。打开弹簧夹c、d、e,A中有氢气产生。在F出口处收集氢气并检验其纯度。
②关闭弹簧夹c,取下截去底部的细口瓶C,打开弹簧夹a,将氢气经导管B验纯后点燃,然后立即罩上无底细口瓶C,塞紧瓶塞,如上图所示。氢气继续在瓶内燃烧,几分钟后火焰熄灭。
③用酒精灯加热反应管E,待无底细口瓶C内水位下降到液面保持不变时,打开弹簧夹b,无底细口瓶C内气体经D进入反应管E,片刻后F中的溶液变红。
回答下列问题:
(1)检验氢气纯度的目的是______________________________________。
(2)C瓶内水位下降到液面保持不变时,A装置内发生的现象是________,防止了实验装置中压强过大。此时再打开弹簧夹b的原因是_________,C瓶内气体的成分是____________。
(3)在步骤③中,先加热铁触媒的原因是________________________。反应管E中发生反应的化学方程式是_____________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】类比是重要的学习方法,类比pH的定义可定义pOH和pKW。在某弱酸HX及其盐NaX的混合溶液中(HX和NaX的含量不确定),c(H+)和c(OH-)存在如图所示的关系,则下列说法不正确的是
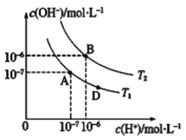
A. 图中温度T2>25℃
B. 若此混合溶液呈酸性且c(HX)=c(NaX),则HX电离能力大于NaX的水解能力
C. 位于AB线段上任意点的溶液均有pH=pOH=![]()
D. 图中D点处溶液中离子浓度:c(Na+)>c(X-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将pH和体积均相同的HNO2和CH3COOH溶液分别稀释,其pH随加水体积的变化如图所示。下列叙述正确的是
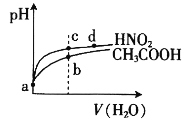
A.电离平衡常数:Ka(CH3COOH)>Ka(HNO2)
B.从c点到d点,溶液中 的值保持不变
的值保持不变
C.溶液中水的电离程度:b>c
D.a点时,相同体积的两溶液分别与NaOH恰好中和后,溶液中的n(Na+)相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是![]() 溶液中各离子浓度的相对大小关系示意图:
溶液中各离子浓度的相对大小关系示意图:
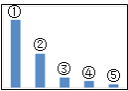
(1)其中,![]() 是 ______。
是 ______。![]() 填微粒符号
填微粒符号![]()
(2)在![]() 溶液中各微粒浓度等式关系正确的是_______
溶液中各微粒浓度等式关系正确的是_______
a. ![]()
b. ![]()
c. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请写出下列物质的电子式:
(1)H2S________; (2)CO2________; (3)N2________;
(4)OH-________; (5)HClO________;(5)Na2O2________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是( )
A.可用明矾和漂白粉处理自来水,二者的作用原理相同
B.室温下向10mLpH=3的醋酸溶液中加水稀释后,溶液中![]() 不变
不变
C.氯水、氨水、王水是混合物,水银、水玻璃是纯净物
D.可用澄清的石灰水鉴别碳酸钠和碳酸氢钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2S2O35H2O在化学定量分析中常用作基准物质,实验室制备原理为:Na2CO3 + 4SO2 + 2Na2S![]() 3Na2S2O3+ CO2设计如图1装置
3Na2S2O3+ CO2设计如图1装置![]() 夹持仪器省略
夹持仪器省略![]() 进行实验。
进行实验。

⑴A中发生的化学反应方程式为 ______;
⑵C中所盛试剂可能是 ______;若要停止A中的化学反应,除取下酒精灯停止加热外,还可以采取的操作是 ______;
⑶学生乙在加热A后,发现液面下的铜丝变黑,如图2。对黑色生成物该学生提出如下假设:
①可能是CuO ②可能是Cu2O ③可能是CuS。
学生丙提出假设②一定不成立,依据是 ______;该生用如下实验进一步验证黑色物质的组成:基于上述假设分析,黑色物质的组成为 ______ (填化学式)
⑷实验室用Na2S2O3标准液测量某工业废水中的I2的浓度。
已知:I2 + 2S2O32- = S4O62- + 2I-
①以淀粉为指示剂,则到达滴定终点的现象是 ______ ;
②若标液Na2S2O3的浓度0.0030mol/L,滴定25.00 mL工业废水消耗该Na2S2O3溶液体积如右图所示,则该废水中I2的浓度为 ______ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com