
【题目】在最新的家用汽车的调查中发现,新车中气体的质量不符合标准.汽车污染主要来源于汽车配件及材料,它们都会产生大量的有毒有机物.其中一种有毒物质A,为了测定有机物A的结构,做如下实验:
①将9.2g该有机物完全燃烧,生成标况下15.68L的CO2和7.2g水;
②用质谱仪测定其相对分子质量,得如图一所示的质谱图;
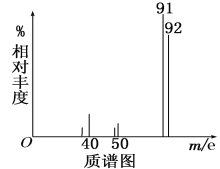
(1)则由图可知该分子的相对分子质量是________,有机物A的分子式为_________。
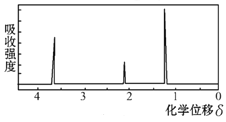
(2)用核磁共振仪处理该化合物,得到如下图所示图谱,图中四个峰的面积之比是1∶2∶2:3,则有机物的名称为________,其苯环上的一氯代物有_______种。若将有机物A与氢气完全加成,则加成后的有机物的一氯代物共有________种。
【答案】92 C7H8 甲苯 3 5
【解析】
(1)根据质谱图中最右边的那个峰就是该物质的相对分子质量,再根据①的质量与产生CO2、H2O的体积及质量,利用元素守恒,可确定其分子式;
(2)根据核磁共振氢谱中有4个吸收峰,结合分子式可以判断出应是甲苯,其苯环上的一氯代物有3种。物质与氢气加成后,看产物有几种不同的H原子就会有几种不同的氯代产物。
(1)从质谱图中可以最大质荷比是92,说明该气体的相对分子质量为92,9.2g该有机物的物质的量是0.1mol,0.1mol该完全燃烧,生成标况下15.68L的CO2和7.2g水,n(C)= 15.68L÷22.4L/mol=0.7mol,含有H原子的物质的量是n(H)=2n(H2O)=2×7.2g÷18g/mol=0.8mol,则1mol物质中含有C原子为7mol,含有H原子的物质的量为8mol,12×7+1×8=92,恰好等于物质的相对分子质量,因此该物质的分子式为C7H8;
(2)由核磁共振氢谱中有4个吸收峰,结合物质的分子式可判断出该物质是甲苯,结构简式为![]() ,其苯环上的一氯代物有3种。Cl原子分别位于苯环上甲基的邻位、间位、对位;若甲苯与氢气完全加成,则加成后的有机物是甲基环己烷
,其苯环上的一氯代物有3种。Cl原子分别位于苯环上甲基的邻位、间位、对位;若甲苯与氢气完全加成,则加成后的有机物是甲基环己烷![]() ,该物质分子内含有5种不同位置的H原子,表示为
,该物质分子内含有5种不同位置的H原子,表示为 ,因此该物质的一氯代物共有5种。
,因此该物质的一氯代物共有5种。


 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源: 题型:
【题目】高锰酸钾是一种典型的强氧化剂。
(1)在用 KMnO4 酸性溶液处理固体 Cu2S 时,发生的反应如下:8MnO4-+5Cu2S+44H+=10Cu2++5SO2↑+8Mn2++22H2O
①还原产物为_____。
②被氧化的元素是_____
③氧化剂与还原剂的物质的量之比为_____
④每生成 2.24 L(标况下)SO2,转移电子数目是_____
(2)用 KMnO4 酸性溶液处理固体 CuS 时,也可将 CuS 反应成 Cu2+和 SO2。写出该离子反应方程式_____
(3)15.8g KMnO4,加热分解后剩余固体 15.0 g。该剩余固体与足量的浓盐酸在加热条件下充分反应,生成单质气体 A,产物中锰元素以 Mn2+存在,则气体 A 的物质的量为_____mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体血液里Ca2+的浓度一般采用mg/cm3来表示。抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用酸性KMnO4溶液滴定即可测定血液样品中Ca2+的浓度。某研究性学习小组设计如下实验步骤测定血液样品小Ca2+的浓度。
[配制酸性KMnO4标准溶液]如图是配制250mL酸性KMnO4标准溶液的过程示意图。
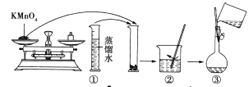
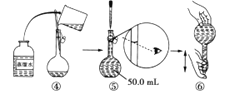
(1)请你观察图示判断其中不正确的操作有(填序号)_____。
(2)如果按照图示的操作所配制的溶液进行实验,在其他操作均正确的情况下,所测得的实验结果将____(填“偏大”或“偏小”或“无影响”)。
[测定血液样品中Ca2+的浓度]抽取血样20.00mL,经过上述处理后得到草酸,再用0.020mol/L酸性KMnO4溶液滴定,使草酸转化成CO2逸出,这时共消耗12.00mL酸性KMnO4溶液。
(3)已知草酸跟酸性KMnO4溶液反应的离子方程式为:2MnO4-+5H2C2O4+6H+=2Mnx++10CO2↑+8H2O则式中的x=___。
(4)滴定时,根据现象___,即可确定反应达到终点。
(5)经过计算,血液样品中Ca2+的浓度为____mg/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请根据官能团的不同对下列有机物进行分类。
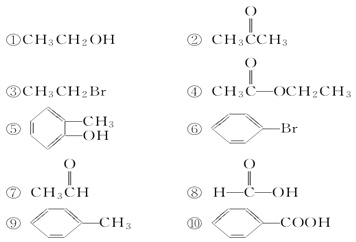
(1)芳香烃:________;
(2) 卤代烃:________;
(3) 醇:________;
(4)醛:________;
(5)羧酸:________;
(6)酯:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学需用480 mL 0.5 mol·L-1Na2CO3溶液,在实验室进行配制。
I.(1)该同学用托盘天平应称量________g Na2CO3粉末,使用容量瓶前必须进行的一步操作是______。
(2)下图是该同学配制的一些关键步骤和操作图。
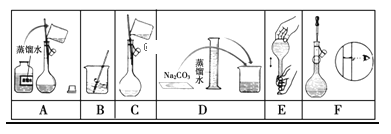
配制过程的先后顺序为(用字母A~F填写)________________。
Ⅱ.若配制1mol/L的稀硫酸溶液500mL
(1)则需要质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为___________mL(计算结果保留一位小数)。如果实验室有10mL 、25mL、50mL量筒,应选用_____________mL规格的量筒最好。
(2)下面操作造成所配稀硫酸溶液浓度偏高的是(_____)
A.溶解后溶液没有冷却到室温就转移
B.转移时没有洗涤烧杯、玻璃棒
C.向容量瓶加水定容时眼睛俯视液面
D.用量筒量取浓硫酸后洗涤量筒并把洗涤液转移到容量瓶
E.摇匀后发现液面低于刻度线,又加蒸馏水至刻度线.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用98%的浓硫酸(![]() )配制100mL浓度为1 molL1的稀硫酸,其操作步骤可分解为以下几步:
)配制100mL浓度为1 molL1的稀硫酸,其操作步骤可分解为以下几步:
a.用量筒量取___________mL的浓硫酸,缓缓注入装有约50mL蒸馏水的烧杯里,并用玻璃棒搅拌.
b.用约30mL蒸馏水,分成三次洗涤烧杯和玻璃棒,将每次洗涤液都倒入M里.
c.将稀释后的硫酸小心地用玻璃棒引流入M.
d.检查M是否发生滴漏.
e.将蒸馏水直接加入M,至液面接近刻度线2cm至3cm处.
f.盖紧瓶塞,反复倾倒振荡,摇匀溶液.
g.用________________向M里逐滴滴入蒸馏水,至液面最低点恰好与环形刻度线相切.据此填写:
(1)正确的操作顺序是______.
(2)进行A步操作时,应量取______mL浓硫酸,选用量筒的规格是(填序号) _________.
a. 10mL b. 50mL c. 1000mL d. 1000mL
(3)配置上述溶液时,多次提到的实验仪器M是______________。步骤G中横线处是_________。
(4)进行A步骤操作时,必须_____后,才能进行后面的操作.
(5)实验操作中,下列操作会对所配溶液的浓度有何影响(填“偏高”“偏低”或“无影响”)
a.洗涤烧杯和玻璃棒的溶液未转入M中__________________
b.定容时,眼睛俯视溶液____________________
c.容量瓶中原残留少量蒸馏水__________________
d.定容后M中液面低于刻度线,又加水定容到刻度线.____________________
e量取浓硫酸时仰视量筒读数____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在a L Al2(SO4)3和(NH4)2SO4的混合溶液中加入b mol BaCl2,恰好使溶液中的SO![]() 完全沉淀;若加入足量强碱并加热(
完全沉淀;若加入足量强碱并加热(![]() ,假设氨气全部逸出)可得到c mol NH3,则原溶液中的Al3+浓度为
,假设氨气全部逸出)可得到c mol NH3,则原溶液中的Al3+浓度为
A.![]() mol/LB.
mol/LB.![]() mol/LC.
mol/LC.![]() mol/LD.
mol/LD.![]() mol/L
mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有以下几种有机物:
①CH4 ②CH3CH2OH ③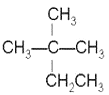 ④葵烷 ⑤CH3COOH ⑥
④葵烷 ⑤CH3COOH ⑥![]()
⑦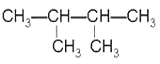 ⑧
⑧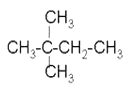 ⑨丙烷
⑨丙烷
请利用上述给出的物质按要求回答下列问题:
(1)相对分子质量为44的烷烃的结构简式为______________;
(2)分子中含有14个氢原子的烷烃的分子式是__________;
(3)与③互为同分异构体的是______________(填序号);
(4)用“>”表示①③④⑨熔沸点高低顺序:_________________(填序号);
(5)在120℃,1.01×105Pa条件下,某种气态烃与足量的O2完全反应后,测得反应前后气体的体积没有发生改变,则该烃是______(填序号);它与⑧互为_________________关系;
(6)有机物⑤和②在一定条件下发生反应的化学方程式是______________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S废气资源化利用途径之一是回收能量并得到单质硫。反应原理为:2H2S(g) + O2(g) = S2(s) + 2H2O(l)△H=-632kJ·mol-1。下图为质子膜H2S燃料电池的示意图。下列说法正确的是( )
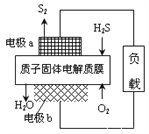
A. 电池在工作时,电流从电极a经过负载流向电极b
B. 电极a上发生的电极反应为: 2H2S - 4e- = S2 + 4 H+
C. 当反应生成64gS2时,电池内部释放632kJ热量
D. 当电路中通过4mol电子时,有4mol H+经质子膜进入负极区
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com