
在10L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g) M(g)+N(g)
M(g)+N(g)
所得实验数据如下表:
| 实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
| n(X) | n(Y) | n(M) | ||
| ① | 700 | 0.40 | 0.10 | 0.090 |
| ② | 800 | 0.10 | 0.40 | 0.080 |
| ③ | 800 | 0.20 | 0.30 | a |
| ④ | 900 | 0.10 | 0.15 | b |
回答下列问题:
(1)实验①中,若5min时测得,n(M)=0.050mo1, 则0至5min时间内,用N表示的平均反应速率为________。
(2)实验③平衡常数为___________,该正反应为____________反应(填“吸热”或“放热”)
(3)能说明上述反应一定达到平衡的条件是_______________________。
A. c(Y)= c(N) B.平均分子量不再变化
C. v正(X) =v逆(M) D.温度和压强一定时,混合气体的密度不再变化
(4)实验③中,达到平衡时,X的转化率为_________________________。
(5)实验③、④中,达到平衡时,a与b的关系为__________(填选项),请解释原因________________。
A. a>2b B. a=2b C.b<a<2b D.a<b
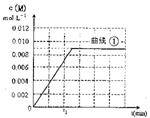
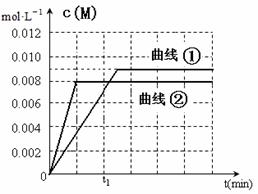
(6)图是实验①中c(M)随时间变化的曲线图,请在图中画出实验②中c(M)随时间变化的曲线图。
【知识点】化学平衡常数和化学平衡的移动G1 G2 G4
【答案解析】(1)0.001mol·L-1·min-1 (2分,数值对单位不写扣1分)
(2)1 (2分) 放热(1分)
(3)C (2分)
(4)60% (2分)
(5)A(1分) 若温度不变,则b = a /2,该反应为放热反应,温度升高,平衡向逆反应方向移动,故b <a /2,即a > 2b(2分)
(6)(2分)(曲线②达平衡时间小于t1且c(M)=0.008才得分)
解析:(1)实验①中,若5min时测得n(M)=0.050mol,浓度是0.0050mol/L,则根据反应的化学方程式可知,同时生成的N的物质的量也是0.0050mol/L ,因此0至5min时间内,用N表示的平均反应速率υ(N)=0.0050mol/L ÷5min=0.001mol·L-1·min-1 ,
(2)实验③与实验②温度相同,所以实验③平衡常数与实验②中平衡常数相同,平衡时M的浓度是0.0080mol/L,则同时生成的N的浓度是0.0080mol/L,消耗X与Y的浓度均是0.0080mol/L,因此平衡时X和Y的浓度分别为0.01mol/L-0.0080mol/L=0.002mol/L,0.04mol/L-0.0080mol/L=0.032mol/L,因此反应的平衡常数k=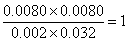 ;相同方法计算①的平衡常数k=
;相同方法计算①的平衡常数k=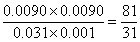 ,可见升温平衡常数减小,即平衡左移,正反应为放热反应;
,可见升温平衡常数减小,即平衡左移,正反应为放热反应;
(3)A. c(Y)= c(N)不能说明正逆速率相等,不能说明反应一定达到平衡 ;B.反应物生成物全是气体,且反应前后物质的量不变,无论平衡是否移动平均分子量都不变化,不能说明反应一定达到平衡;
C. v正(X) =v逆(M) ,能说明反应一定达到平衡 ; D.温度和压强一定时,无论平衡是否移动混合气体的密度都不变化,不能说明反应一定达到平衡 ;只有C符合题意。
(4)设实验③中,达到平衡时,X减小的浓度为x
X(g) + Y(g) M(g)+N(g)
M(g)+N(g)
开始 0.02mol/L 0.03mol/L 0 0
x x x x
平衡0.02mol/L-x 0.03mol/L-x x x
代入平衡常数表达式,利用k=1,解得x=0.012mol/L,X的转化率为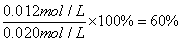
(5)实验③、④中,若温度不变构成等效平衡,则b = a /2,该反应为放热反应,温度升高,平衡向逆反应方向移动,故b <a /2,即a>2b 。
(6)根据升高温度反应速率加快,实验②中应该先达平衡,平衡时M的浓度为0.008mol/L,满足以上两点画图即可。
【思路点拨】本题考查了化学平衡常数和化学平衡的移动,运用同一温度下化学平衡常数不变可以顺利解决问题。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
.下列实验设计及其对应的离子方程式均正确的是( )
A.用FeCl3溶液腐蚀铜线路板:Cu + 2Fe3+ = Cu2+ + 2Fe2+
B.Na2O2与H2O反应制备O2 :Na2O2 + H2O = 2Na+ + 2OH- + O2↑
C.将氯气溶于水制备次氯酸:Cl2 + H2O = 2H+ + Cl- + ClO-
D.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:
2MnO + 6H+ + 5H2O2 = 2Mn2+ + 5O2↑ + 8H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
盆烯是近年合成的一种有机物,它的分子结构可简化表示为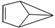 (其中H原子已略去),下列关于盆烯的说法中错误的是( )
(其中H原子已略去),下列关于盆烯的说法中错误的是( )
A.盆烯是苯的一种同分异构体
B.盆烯分子中所有的碳原子不可能在同一平面上
C.盆烯是乙烯的一种同系物
D.盆烯在一定条件下可以发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
某物质只含C、H、O三种元素,其分子模型如图所示,分子中共有12个原子(图中球与球之间的连线代表单键、双键等化学键)。

(1)该物质的结构简式为________。
(2)该物质中所含官能团的名称为____________________________________________。
(3)下列物质中,与该产品互为同系物的是______(填序号),互为同分异构体的是____________。
①CH3CHCHCOOH ②CH2CHCOOCH3
③CH3CH2CHCHCOOH
④CH3CH(CH3)COOH
查看答案和解析>>
科目:高中化学 来源: 题型:
用钠融法可定性确定有机物中是否存在氯、溴、硫、氮等元素。下列有关有机物与足量钠反应,各元素的转化结果正确的是( )
A.碳元素转化为NaCN
B.氯元素转化为高氯酸钠
C.溴元素转化为溴化钠
D.硫元素转化为硫酸钠
查看答案和解析>>
科目:高中化学 来源: 题型:
某有机化合物仅由碳、氢、氧三种元素组成,其相对分子质量小于150,若已知其中氧的质量分数为50%,则分子中碳原子的个数最多为( )
A.4 B.5 C.6 D.7
查看答案和解析>>
科目:高中化学 来源: 题型:
某原电池装置如右图所示,盐桥中装有用饱和氯化钾溶液浸泡过的琼脂。下列叙述正确的是
A.原电池工作一段时间后,FeCl2溶液中c(Cl-)会增大
B.此电池工作原理与硅太阳能电池工作原理相同
C.Fe为正极,石墨上发生的反应为:2H++2e-=H2↑
D.若装置中的盐桥用铁丝代替,电流表指针无偏转
查看答案和解析>>
科目:高中化学 来源: 题型:
兰尼镍(Rancy-Ni)是一种带有多孔结构的细小晶粒组成的镍铝合金,广泛用作烯烃、氢化反应的催化剂。其高催化活性源于镍本身的催化性质和其多孔结构对氢气的强吸附性。以镍、铝为原料制备兰尼镍的工艺流程如下:
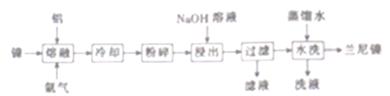
(1)“熔融”时通入氩气的目的是_____________________________________。
(2)“浸出”是整个流程的核心步骤,该步骤的目的是_____________________,发生反应的离子方程式为____________________________________。浸出反应所用NaOH溶液的浓度需达5mol·L-1以上,若用NaOH稀溶液浸出时,则会产生Al(OH)3沉淀阻止浸出反应持续进行,产生Al(OH)3的化学方程式为___________________________。
(3)滤液的主要成分与过量CO2反应的离子方程式为__________________。
(4)使用新制的兰尼镍进行氢化反应有时不需要加入氢气即可完成反应得到氢化产物,原因是________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com