
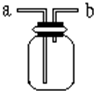
 如图所示是中学化学实验中常见的装置,它有多种用途.
如图所示是中学化学实验中常见的装置,它有多种用途.分析 (1)洗气时应将气体从长导管进气,可用氢氧化钠溶液除去二氧化碳;
(2)用排空气法收集H2,因氢气的密度比空气小,气体从短管进,二氧化碳密度比空气大,应用向上排空法.
解答 解:(1)洗气时应将气体从长导管进气,即从a进气,二氧化碳与氢氧化钠溶液反应,应用氢氧化钠溶液除杂,故答案为:a;B;
(2)氢气的密度比空气小,应用向下排空气法收集,则气体从b进,二氧化碳密度比空气大,应用向上排空法,即二氧化碳从a端进,故答案为:b;a.
点评 本题考查较为综合,涉及气体的制备、检验和收集,侧重于学生的分析能力和实验能力的考查,为高考常见题型,难度不大,注意把握物质的性质以及实验方法.


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 将高温水蒸气通过炽热的铁粉,铁粉变红色 | |
| B. | 向Fe(OH)3胶体中滴加稀H2SO4,先出现沉淀,后沉淀溶解 | |
| C. | 向FeCl2溶液中加入几滴KSCN溶液,溶液变为血红色,则FeCl2溶液完全变质 | |
| D. | 铝在空气中耐腐蚀,所以铝是不活泼金属 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2LSO3所含原子数为2NA | |
| B. | 标况下11.2LNO和11.2LO2混合后所得气体分子数为NA | |
| C. | 0.1mol•L-1的NaHSO4溶液中,阳离子的数目之和为0.2NA | |
| D. | 1mol SiO2晶体中含有硅氧键的数目为4NA.而1mol金刚石中含碳碳键的数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
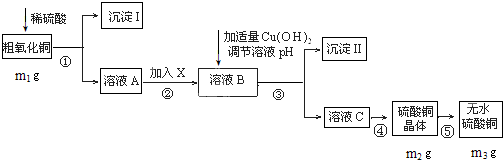
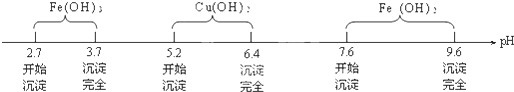
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
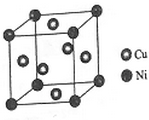 东晋《华阳国志•南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品.回答下列问题:
东晋《华阳国志•南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
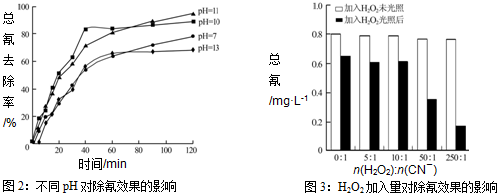
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com