
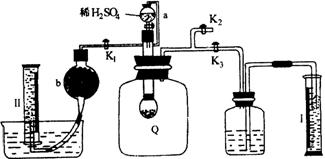
(1)Q内发生化学反应时,生成的气体是__________________________________________。
(2)为了测定反应生成气体的总体积,滴加稀硫酸之前,K1、K2、K3中应当关闭的是_______________,应当打开的是_______________。
(3)当上述反应停止,将K1、K2、K3均处于关闭状态,然后先打开K2,再缓缓打开K1,这时可观察到的现象是__________________________________________。
(4)b中装的固体试剂是___________________________________________,为什么要缓缓打开K1?___________________________________________________________。
(5)实验结束时,量筒Ⅰ中有x mL水,量简Ⅱ中收集到y mL气体(已折算成标准状态),则过氧化钠的纯度的数学表达式是___________________________(化成最简表达式)。
 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:阅读理解
 (2013?闸北区二模)含有硫的化合物在工业生产中应用广泛,回答下列问题:
(2013?闸北区二模)含有硫的化合物在工业生产中应用广泛,回答下列问题:| 装置 | A (试管+粉末) |
B | C |
| 反应前 | 42.0g | 75.0g | 140.0g |
| 反应后 | 37.0g | 79.0g | 140.5g |
| 高温 |
| 高温 |
查看答案和解析>>
科目:高中化学 来源:湖南师大附中2006-2007学年度上学期高三年级月考(二)、化学 题型:058
| |||||||||||||||||||||||
查看答案和解析>>
科目:高中化学 来源: 题型:

图15-11
(1)Q内发生化学反应时,生成的气体是_____________。
(2)为了测定反应生成气体的总体积,滴加稀硫酸之前,K1、K2、K3中应当关闭的是__________,应当打开的是_____________。
(3)当上述反应停止,将K1、K2、K3均处于关闭状态,然后先打开K2,再缓缓打开K1,这时可观察到的现象是__________________________________________________________。
(4)b中装的固体试剂是___________,为什么要缓缓打K1__________________________。
(5)实验结束时,量筒Ⅰ中有x mL水,量筒Ⅱ中收集到y mL气体(已折算成标准状况),则过氧化钠的纯度的数学表达式是__________________________(需化成最简表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
为了测定已部分变质的过氧化钠样品的纯度,设计右图所示的实验装置,图中Q为弹性良好的气球,称取一定量的样品放入其中,按图安装好仪器,打开了漏斗的活塞,将稀硫酸滴入气球中。请填空:
|
(1)Q内发生化学反应时,生成的气体是 。
(2)为了测定反应生成气体的总体积,滴加稀硫酸之前,K1、K2、K3中应当关闭的是 ,应当打开的是 。
(3)当上述反应停止,将K1、K2、K3均处于关闭状态,然后先打开K2,再缓缓打开K1,这时可观察到的现象是 。
(4)b中装的固体试剂是 ,为什么要缓缓打开K1 。
(5)实验结束时,量筒I中有x mL水,量筒II中收集到y mL气体(已折算成标准状态),则过氧化钠的纯度的数学表达式是 (需化成最简表达式。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com