
【题目】已知可逆反应:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)△H=-1025kJ.mo1-1,若反应物起始物质的量相同,下列关于该反应的示意图不正确的是( )
4NO(g)+6H2O(g)△H=-1025kJ.mo1-1,若反应物起始物质的量相同,下列关于该反应的示意图不正确的是( )
A.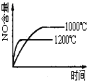 B.
B.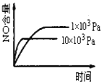 C.
C.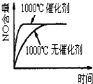 D.
D.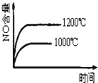
科目:高中化学 来源: 题型:
【题目】某实验小组用下列装置进行乙醇催化氧化的实验。
(1)实验过程中铜网出现__________色和__________色交替的现象。
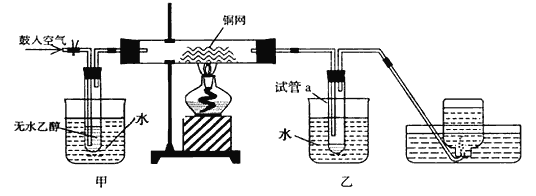
(2)甲和乙两个水浴作用不相同,其中甲中装的是热水,乙中装的是冷水。他们的作用依次为______________,________________。
(3)反应进行一段时间后,试管a中能 收集到若干种物质,其中一种液体能使紫色石蕊试纸显红色, 要除去该物质,可在混合液中加入_____________(填写字母)除去。
a.氯化钠溶液 b.苯 c.碳酸氢钠溶液 d.四氯化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《后汉书·郡国志》中记载:“石出泉水……其水有肥,燃之极明,不可食,县人谓之石漆。”《酉阳杂俎》一书:“高奴县石脂水,水腻,浮上如漆,采以膏车及燃灯极明。”下列说法正确的是 ( )
A. 上述材料所说“石漆”“石脂水”是石油,在工业上通过石油分馏得到苯和甲烷等
B. 塑料聚乙烯(PE)的单体可以由石油裂解得到
C. 聚乙烯可以使溴水褪色
D. 三大合成材料分别是合金、合成橡胶和合成纤维
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于二氧化硅的说法不正确的是( )
A. 硅元素是地壳中含量仅次于氧的元素
B. 地壳中的岩石、沙子和土壤中都含有二氧化硅
C. 纯净的二氧化硅是一种无色透明的晶体
D. 二氧化硅是一种熔点高、硬度大、能溶于水的固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知乙酸(HA)的酸性比甲酸(HB)弱,常温下0.1mol/L HA和0.1mol/L HB的pH均大于2。在物质的量浓度均为0.1mol/L的NaA和NaB混合溶液中,下列排序正确的是( )
A. c(OH-)>c(HA)>c(HB)>c(H+) B. c(OH-)>c(A-)>c(B-)>c(H+)
C. c(OH-)>c(B-)>c(A-)>c(H+) D. c(OH-)>c(HB)>c(HA)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷为VA族元素,金属冶炼过程产生的含砷有毒废弃物需处理与检测。
I.冶炼废水中砷元素主要以亚砷酸(H3AsO3)形式存在,可用化学沉降法处理酸性高浓度含砷废水,其工艺流程如下:

已知:①As2S3与过量的S2-存在以下反应:As2S3(s)+3S2-(aq)![]() 2AsS33-(aq);
2AsS33-(aq);
②亚砷酸盐的溶解性大于相应砷酸盐。
(1)亚砷酸中砷元素的化合价为________;砷酸的第一步电离方程式为_____________。
(2)“一级沉砷”中FeSO4的作用是___________;“二级沉砷”中H2O2与含砷物质反应的化学方程式为_____________。
(3)沉淀X为___________(填化学式)。
Ⅱ.冶炼废渣中的砷元素主要以As2S3的形式存在,可用古氏试砷法半定量检测(As的 最低检出限为3.0×10-6g)。
步骤1:取10g废渣样品,粉碎后与锌粉混合,加入H2SO4共热,生成AsH3气体。
步骤2:将AsH3气体通入AgNO3溶液中,生成银镜和As2O3。
步骤3:取1g废渣样品,重复上述实验,未见银镜生成。
(4)AsH3的电子式为_______________。
(5)步骤2的离子方程式为_________________。
(6)固体废弃物的排放标准中,砷元素不得高于4.0×10-5g·kg-1,请通过计算说明该排放的废渣中砷元素的含量_______(填“符合”、“不符合”)排放标准,原因是__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国是干电池的生产和消费大国。某科研团队设计了以下流程对碱性锌锰干电池的废旧资源进行回收利用:

已知:①Ksp(MnS)=2.5×10-13,Ksp(ZnS)=1.6×10-24
②Mn(OH)2开始沉淀时pH为8.3,完全沉淀的pH为9.8
⑴碱性锌锰干电池是以锌粉为负极,二氧化锰为正极,氢氧化钾溶液为电解质。电池总反应为2MnO2+ Zn+2KOH= 2MnOOH+K2ZnO2,请写出电池的正极反应式_____________;
⑵为了提高碳包的浸出效率,可以采取的措施有________________________;(写一条即可)
⑶向滤液1中加入MnS的目的是__________________________________________;
⑷已知MnSO4的溶解度曲线如图所示,从滤液2中析出MnSO4·H2O晶体的操作是蒸发结晶、____________________、洗涤、低温干燥;

⑸为了选择试剂X,在相同条件下,分别用3 g碳包进行制备MnSO4的实验,得到数据如表1,请写出最佳试剂X与碳包中的主要成分发生反应的化学方程式_____________。
⑹工业上经常采用向滤液2中加入NaHCO3溶液来制备MnCO3,不选择Na2CO3溶液的原因是___________________________________;
⑺该科研小组利用EDTA(乙二胺四乙酸二钠,阴离子简写为Y2-)进行络合滴定测定Mn2+在电池中的百分含量,化学方程式可以表示为Mn2++Y2-=MnY。实验过程如下:
准确称量一节电池的质量平均为24.00g,完全反应后,得到200.00mL滤液2,量取10.00mL滤液2稀释至100.00mL,取20.00mL溶液用0.0500molL-1EDTA标准溶液滴定,平均消耗标准溶液22.00mL,则该方案测得Mn元素的百分含量为________。(保留3位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用Na2CO3·10H2O晶体,配制0.2 mol·L-1的Na2CO3溶液480 mL。
(1)应称取Na2CO3·10H2O晶体的质量:____________。定容时,向容量瓶中加水,至1~2cm时,改用_________加水至刻度,加盖摇匀;
(2)根据下列操作对所配溶液的浓度产生的影响,完成下列要求:
①Na2CO3·10H2O晶体失去了部分结晶水 ②用“左码右物”的称量方法称量晶体(使用游码) ③碳酸钠晶体不纯,其中混有氯化钠 ④称量碳酸钠晶体时所用砝码生锈 ⑤容量瓶未经干燥使用。 其中引起所配溶液浓度偏高的有______________(填序号,下同),偏低的有______________,无影响的有_______________________________。
(3)下列操作中,容量瓶所不具备的功能有________________。
A.配制一定体积准确浓度的标准溶液 B.贮存溶液
C.测量容量瓶规格以下的任意体积的液体 D.准确稀释某一浓度的溶液
E.用来加热溶解固体溶质
(4)某同学改用固体Na2CO3配制上述Na2CO3溶液的过程如图所示:

你认为该同学的错误步骤有_________________。
A.1处 B.2处 C.3处 D.4处
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在2 L密闭容器中投入一定量的A、B,发生反应3A(g)+bB(g) ![]() cC(g)。12 s时达到平衡,生成C的物质的量为0.8 mol,反应过程如图所示。下列说法正确的是
cC(g)。12 s时达到平衡,生成C的物质的量为0.8 mol,反应过程如图所示。下列说法正确的是

A. 前12 s内,A的平均反应速率为0. 025 mol L-1 s-1
B. 12 s后,A的消耗速率等于B的生成速率
C. 化学计量数之比b:c==1:2
D. 反应开始到12 s,A的转化率为70%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com