
 如图是常温下等物质的量浓度的部分短周期元素最高价氧化物对应水化物的稀溶液的pH与原子序数的关系图,Z的氧化物是两性氧化物.下列说法正确的是( )
如图是常温下等物质的量浓度的部分短周期元素最高价氧化物对应水化物的稀溶液的pH与原子序数的关系图,Z的氧化物是两性氧化物.下列说法正确的是( )| A. | E、X、L三种元素的非金属性强弱关系为E<L<X | |
| B. | 同浓度的W、R两种元素的最高价氧化物对应水化物的溶液中,pH后者更小 | |
| C. | 元素Z、J对应的单质均能与Y的最高价氧化物对应的水化物反应生成H2,故它们的性质相同 | |
| D. | 元素X、Y、W形成的某化合物的溶液能与W的最高价氧化物对应的水化物反应生成气体 |
分析 均为短周期元素,Y、Z的最高价氧化物对应水化物呈碱性,Z的氧化物是两性氧化物,Z为Al,则Y为Na;X、J、W、R的最高价氧化物对应水化物呈酸性,由溶液pH及原子序数,可推知E为碳、X为氮、L为氧、Y为Na、Z为Al、J为Si、W为S、R为Cl,以此来解答.
解答 解:均为短周期元素,Y、Z的最高价氧化物对应水化物呈碱性,Z的氧化物是两性氧化物,Z为Al,则Y为Na;X、J、W、R的最高价氧化物对应水化物呈酸性,由溶液pH及原子序数,可推知E为碳、X为氮、L为氧、Y为Na、Z为Al、J为Si、W为S、R为Cl,
A.同周期从左向右非金属性增强,则E、X、L三种元素的非金属性强弱关系为E<X<L,故A错误;
B.同浓度的W、R两种元素的最高价氧化物对应水化物的溶液中,高氯酸的酸性最强,则pH后者更小,故B正确;
C.Z为金属元素,Si为非金属元素,化学性质不同,故C错误;
D.X、Y、W形成的某化合物(亚硫酸钠)的溶液能与W的最高价氧化物对应的水化物(硫酸)反应生成二氧化硫气体,故D正确;
故选BD.
点评 本题考查原子结构与元素的性质,为高频考点,把握Z为Al及元素化合物知识为解答的关键,侧重分析与推断能力的考查,注意高氯酸为含氧酸中酸性最强的酸,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 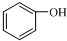 和 和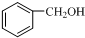 互为同系物 互为同系物 | |
| B. | 教材中做石蜡油分解实验和石油蒸馏实验都会用到碎瓷片,其作用是相同的 | |
| C. | 某烃的结构用键线式表示为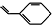 ,该烃与Br2按物质的量之比1:1加成时所得产物有5种 ,该烃与Br2按物质的量之比1:1加成时所得产物有5种 | |
| D. | 105℃,1.01×105Pa时,aL某气态烃在bL氧气(足量)中完全燃烧,将所得混合气体通过浓硫酸剩余气体cL,则烃燃烧生成的水蒸气的体积就是(a+b-c)L(气体体积在相同条件下测定) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝不易发生化学反应 | |
| B. | 铝的氧化物容易发生还原反应 | |
| C. | 铝不易被氧气氧化 | |
| D. | 铝表面致密的氧化膜能阻止铝进一步被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
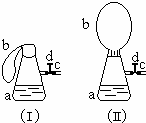 如图(Ⅰ)中锥形瓶a内放入43.8g10%的稀盐酸,b是未充气的气球,里边放有4g碳酸钙粉末,将它紧紧套在瓶a口上,胶管c套在瓶的侧口,并用弹簧夹d夹紧(瓶口和侧口都不漏气).将图Ⅰ的装置在托盘天平上称量,质量为W1克.根据实验现象填写下列空白:
如图(Ⅰ)中锥形瓶a内放入43.8g10%的稀盐酸,b是未充气的气球,里边放有4g碳酸钙粉末,将它紧紧套在瓶a口上,胶管c套在瓶的侧口,并用弹簧夹d夹紧(瓶口和侧口都不漏气).将图Ⅰ的装置在托盘天平上称量,质量为W1克.根据实验现象填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
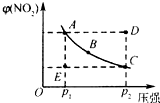 对于N2O4(g)?2NO2(g)在温度一定时,平衡体系中NO2的体积分数V(NO2)%随压强的变化情况如图所示(实线上的任何一点为对应压强下的平衡点).
对于N2O4(g)?2NO2(g)在温度一定时,平衡体系中NO2的体积分数V(NO2)%随压强的变化情况如图所示(实线上的任何一点为对应压强下的平衡点).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
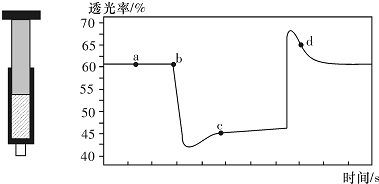
| A. | b点的操作是拉伸注射器 | |
| B. | d点:v(正)>v(逆) | |
| C. | c点与a点相比,c(NO2)增大,c(N2O4)减小 | |
| D. | 若不忽略体系温度变化,且没有能量损失,则T(b)<T(c) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,P元素属于ds区元素.
,P元素属于ds区元素.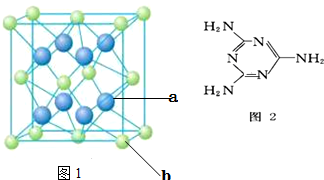
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com