
 的起还原剂作用,
的起还原剂作用,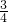 的氨气中氮元素化合价不变,仅作为反应物参加反应.据此解答.
的氨气中氮元素化合价不变,仅作为反应物参加反应.据此解答. 的起还原剂作用,被氧化,
的起还原剂作用,被氧化,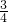 的氨气中氮元素化合价不变,仅作为反应物参加反应.
的氨气中氮元素化合价不变,仅作为反应物参加反应. 的起还原剂作用,
的起还原剂作用, =4mol.故发生氧化的物质为氨气,其物质的量为4mol.
=4mol.故发生氧化的物质为氨气,其物质的量为4mol. 的起还原剂作用,可以根据氮元素化合价变化利用氮原子守恒计算起还原剂作用的氨气物质的量.
的起还原剂作用,可以根据氮元素化合价变化利用氮原子守恒计算起还原剂作用的氨气物质的量. 

科目:高中化学 来源: 题型:
在8NH3+3Cl2====6NH4Cl+N2反应中,若有2 mol N2生成,发生氧化反应的NH3的物质的量是( )
A.16mol B.8mol C.4mol D.3 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com