
| A. | 氧化性:浓硝酸大于稀硝酸 | |
| B. | 与相同质量的铜(反应完全)反应中转移的电子总数相同 | |
| C. | 与锌反应:前者生成NO2,后者生成H2 | |
| D. | 与铜反应:前者生成气体颜色深,后者生成气体颜色浅 |
分析 A.硝酸浓度越大,氧化性越强;
B.铜的物质的量相同,与浓硝酸或稀硝酸反应都生成硝酸铜,铜的化合价都是由0价升高到+2价,铜失去电子数相同;
C.硝酸为强氧化性酸,与金属反应不生成氢气;
D.依据铜与浓硝酸、稀硝酸反应还原产物解答.
解答 解:A.硝酸浓度越大,氧化性越强,所以氧化性:浓硝酸大于稀硝酸,故A正确;
B.铜的物质的量相同,与浓硝酸或稀硝酸反应都生成硝酸铜,铜的化合价都是由0价升高到+2价,铜失去电子数相同,故反应中转移的电子总数相等,故B正确;
C.锌与浓硝酸、稀硝酸反应都不会生成氢气,前者生成二氧化氮,后者生成一氧化氮,故C错误;
D.铜与浓硝酸反应生成红棕色的二氧化氮,与稀硝酸反应生成无色的一氧化氮,故D正确;
故选C.
点评 本题考查了铜与浓硝酸和稀硝酸反应的比较,熟悉硝酸的性质是解题关键,注意硝酸浓度越大氧化性越强.


科目:高中化学 来源: 题型:选择题
| A. | 放电时铁做负极,NiO2做正极 | |
| B. | 充电时阴极上的电极反应为:Fe(OH)2+2e-═Fe+2OH- | |
| C. | 放电时,电解质溶液中的阴离子是向正极方向移动 | |
| D. | 蓄电池的两个电极必须浸入在碱性溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它的结构与P4相同 | |
| B. | 它的摩尔质量为64 | |
| C. | 它是氧气的同素异形体 | |
| D. | 它是由两个氧分子通过分子间作用力结合而成的新微粒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知反应2A(g)+B(g)?3C(g)△H>0,若温度降低,逆反应速率减小 | |
| B. | 在恒容容器中发生反应N2(g)+3H2(g)?2NH3(g),若往容器中充入He,正逆反应的速率均不变 | |
| C. | 当一定量的锌粉和4 mol•L-1的过量盐酸反应时,为了减慢反应速率,又不影响产生H2的总量,可向容器中加入一些水或硝酸钠溶液 | |
| D. | 对任何一个化学反应,温度发生变化,化学反应速率一定发生变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaH中氢负离子的最外层有两个电子 | |
| B. | 标准状况下,NaH+H2O=NaOH+H2↑中,每生成22.4L氢气,有1mol电子转移 | |
| C. | NaH跟液氨反应时,有NaNH2生成 | |
| D. | NaH中H-半径比Li+半径小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 铁电极的电极反应式为Fe-3e-═Fe3+ | |
| B. | 溶液中的H+移向Fe电极 | |
| C. | 该装置中能量转化方式为电能转化为化学能 | |
| D. | 电子从铁棒经导线流入石墨棒 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
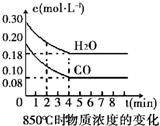 在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2 (g)△H<0.
在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2 (g)△H<0.| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用稀硫酸可除去钢铁表面的铁锈 | |
| B. | 使用焰色反应可检验氯化钠中的钠离子 | |
| C. | 通过丁达尔效应可区分NaCl溶液和Al(OH)3胶体 | |
| D. | 向溶液中滴入硝酸银溶液产生白色沉淀,可证明含有Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com