
(1)¼×“¼æÉ×÷ĪŖČ¼ĮĻµē³ŲµÄŌĮĻ”£ŅŌCH4ŗĶH2OĪŖŌĮĻ,ĶعżĻĀĮŠ·“Ó¦Ą“Öʱø¼×“¼”£
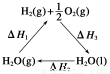
¢ń:CH4 (g)+H2O(g)=CO(g)+3H2(g) ¦¤H=+206.0 kJ”¤mol-1
¢ņ:CO(g)+2H2(g)=CH3OH(g) ¦¤H=-129.0 kJ”¤mol-1
CH4(g)ÓėH2O(g)·“Ӧɜ³ÉCH3OH (g)ŗĶH2(g)µÄČČ»Æѧ·½³ĢŹ½ĪŖ ”£
(2)¼×“¼¶ŌĖ®ÖŹ»įŌģ³ÉŅ»¶ØµÄĪŪČ¾,ÓŠŅ»ÖÖµē»Æѧ·ØæÉĻū³żÕāÖÖĪŪČ¾,ĘäŌĄķŹĒ:Ķصēŗó,½«Co2+Ńõ»Æ³ÉCo3+,Č»ŗóŅŌCo3+×÷Ńõ»Æ¼Į°ŃĖ®ÖŠµÄ¼×“¼Ńõ»Æ³ÉCO2¶ų¾»»Æ”£ŹµŃéŹŅÓĆČēĶ¼×°ÖĆŹµĻÖÉĻŹö¹ż³Ģ:

¢ŁŠ“³öŃō¼«µē¼«·“Ó¦Ź½: ”£
¢ŚŠ“³ö³żČ„¼×“¼µÄĄė×Ó·½³ĢŹ½: ”£
(3)Š“³öŅŌNaHCO3ČÜŅŗĪŖ½éÖŹµÄAl”ŖæÕĘųŌµē³ŲµÄøŗ¼«·“Ó¦Ź½: ”£
(4)ČĖ¹¤ÉöŌąæɲÉÓĆ¼ä½Óµē»Æѧ·½·Ø³żČ„“śŠ»²śĪļÖŠµÄÄņĖŲ,ŌĄķČēĶ¼:

¢ŁµēŌ“µÄøŗ¼«ĪŖ (Ģī”°A”±»ņ”°B”±)”£
¢ŚŃō¼«ŹŅÖŠ·¢ÉśµÄ·“Ó¦ŅĄ“ĪĪŖ ”£
¢Ūµē½ā½įŹųŗó,Ņõ¼«ŹŅČÜŅŗµÄpHÓėµē½āĒ°Ļą±Č½« ;ČōĮ½¼«¹²ŹÕ¼Æµ½ĘųĢå13.44 L(±ź×¼×“æö),Ōņ³żČ„µÄÄņĖŲĪŖ g (ŗöĀŌĘųĢåµÄČܽā)”£
(1)CH4(g)+H2O(g)=CH3OH (g)+H2(g) ¦¤H=+77.0 kJ”¤mol-1
(2)¢ŁCo2+-e-=Co3+
¢Ś6Co3++CH3OH+H2O=CO2”ü+6Co2++6H+
(3) Al-3e-+3HC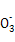 =Al(OH)3”ż+3CO2”ü
=Al(OH)3”ż+3CO2”ü
(4)¢ŁB ¢Ś2Cl--2e-=Cl2”ü”¢CO(NH2)2+3Cl2+H2O=CO2+N2+6HCl
¢Ū²»±ä 7.2
”¾½āĪö”æ(1)¢ń:CH4(g)+H2O(g)=CO(g)+3H2(g) ¦¤H=+206.0 kJ”¤mol-1
¢ņ:CO(g)+2H2(g)=CH3OH(g) ¦¤H=-129.0 kJ”¤mol-1
¢ń+¢ņµĆ:CH4(g)+H2O(g)=CH3OH(g)+H2(g) ¦¤H=+77.0 kJ”¤mol-1
(2)øł¾Ż·“Ó¦ŌĄķ,Ķصēŗó,½«Co2+Ńõ»Æ³ÉCo3+,Č»ŗóŅŌCo3+×÷Ńõ»Æ¼Į°ŃĖ®ÖŠµÄ¼×“¼Ńõ»Æ³ÉCO2¶ų¾»»Æ,ŌņĶصēŹ±Co2+Ź§µē×Ó,Ńō¼«µÄµē¼«·“Ó¦Ź½ĪŖCo2+-e-=Co3+”£³żČ„¼×“¼µÄĄė×Ó·½³ĢŹ½6Co3++CH3OH+H2O=CO2”ü+6Co2++6H+”£
(3)Al”ŖæÕĘųŌµē³ŲĀĮ×÷øŗ¼«,Ź§µē×ÓÉś³ÉĀĮĄė×Ó,ŗĶĢ¼ĖįĒāÄĘ·“Ӧɜ³ÉĒāŃõ»ÆĀĮŗĶ¶žŃõ»ÆĢ¼”£øŗ¼«:Al-3e-+3HC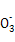 =Al(OH)3”ż+3CO2”ü”£
=Al(OH)3”ż+3CO2”ü”£
(4)¢ŁÓÉĶ¼æÉÖŖ²śÉśCl2µÄµē¼«ĪŖŃō¼«,¹ŹAĪŖÕż¼«,BĪŖøŗ¼«”£¢ŚŃō¼«ŹŅ·¢ÉśµÄ·“Ó¦Ź×ĻČĪŖ2Cl--2e-=Cl2”ü”£ÓɲśĪļCO2”¢N2æÉÖŖCO(NH2)2ŌŚ“ĖŹŅ±»Ńõ»Æ,Cl2±»»¹Ō,¹Ź·“Ó¦ĪŖCO (NH2)2+3Cl2+H2O=CO2+N2+6HCl”£¢ŪŅõ¼«·¢Éś2H++2e-=H2”ü,Ķ¬Ź±Ńō¼«ŹŅHClµēĄė³öµÄH+ĶعżÖŹ×Ó½»»»Ä¤½ųČėŅõ¼«ŹŅ,“Ó¶ųŹ¹Ņõ¼«ŹŅH+ÅØ¶Č±£³Ö²»±ä,¼“pHÓėµē½āĒ°Ļą±Č²»±ä”£Į½¼«¹²ŹÕ¼Æµ½µÄĘųĢån(ĘųĢå)=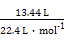 =0.6 mol,ÓÉ:
=0.6 mol,ÓÉ:
CO(NH2)2”«3Cl2”«3H2”«CO2”«N2
60 g 5 mol
m[CO(NH2)2] 0.6 mol
µĆ:m[CO(NH2)2]=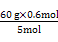 =7.2 g”£
=7.2 gӣ


 ĢģĢģĻņÉĻŅ»±¾ŗĆ¾ķĻµĮŠ“š°ø
ĢģĢģĻņÉĻŅ»±¾ŗĆ¾ķĻµĮŠ“š°ø Š”ѧɜ10·ÖÖÓÓ¦ÓĆĢāĻµĮŠ“š°ø
Š”ѧɜ10·ÖÖÓÓ¦ÓĆĢāĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2014øßæ¼»Æѧ¶žĀÖ×ØĢāĶ»ĘĘ ×ØĢā¶ž»ÆѧÓĆÓļ¼°³£ÓĆ¼ĘĮæĮ·Ļ°¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø £©
A£®4.2 g±ūĻ©ÖŠĖłŗ¬µÄ¹²¼Ū¼üŹżÄæĪŖ0.6”Į6.02”Į1023
B£®ŗ¬1 mol H2SO4µÄÅØĮņĖįÓė×ćĮæĶ·“Ó¦×ŖŅʵĵē×Ó×ÜŹżĪŖ6.02”Į1023
C£®ĻąĶ¬Ģõ¼žĻĀ£¬1 L COŗĶH2µÄ»ģŗĻĘųĢåĶźČ«Č¼ÉÕĻūŗÄ0.5 L O2
D£®ĻąĶ¬ĪļÖŹµÄĮæµÄOH£ŗĶCH3+ŗ¬ÓŠĻąĶ¬ŹżÄæµÄµē×Ó
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2014øßæ¼»Æѧ¶žĀÖ×ØĢāĶ»ĘĘ ×ØĢāĘß»Æѧ·“Ó¦ÓėÄÜĮæĮ·Ļ°¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ijæĘѧ¼ŅĄūÓƶžŃõ»Æīę(CeO2)ŌŚĢ«ŃōÄÜ×÷ÓĆĻĀ½«H2O”¢CO2×Ŗ±äĪŖH2”¢CO”£Ęä¹ż³ĢČēĻĀ£ŗ
mCeO2 (m£x)CeO2”¤xCe£«xO2
(m£x)CeO2”¤xCe£«xO2
(m£x)CeO2”¤xCe£«xH2O£«xCO2 mCeO2£«xH2£«xCO
mCeO2£«xH2£«xCO
ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ£Ø £©
A£®øĆ¹ż³ĢÖŠCeO2ƻӊĻūŗÄ
B£®øĆ¹ż³ĢŹµĻÖĮĖĢ«ŃōÄÜĻņ»ÆѧÄܵÄ×Ŗ»Æ
C£®Ķ¼ÖŠ¦¤H1£½¦¤H2£«¦¤H3
D£®ŅŌCOŗĶO2¹¹³ÉµÄ¼īŠŌČ¼ĮĻµē³ŲµÄøŗ¼«·“Ó¦Ź½ĪŖCO£«4OH££2e£=CO32-£«2H2O
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2014øßæ¼»Æѧ¶žĀÖ×ØĢāĶ»ĘĘ ×ØĢāŅ»ĪļÖŹµÄ×é³ÉŠŌÖŹŗĶ·ÖĄąĮ·Ļ°¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
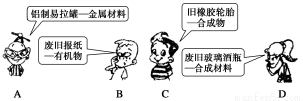
ĻĀĆęŹĒ4Ī»Ķ¬Ń§¶ŌŅ»Š©·ĻĘ·°“ĘäÖ÷ŅŖ³É·Ö½ųŠŠµÄ·ÖĄą£¬ĘäÖŠ“ķĪóµÄŹĒ£Ø £©
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2014øßæ¼»Æѧ×ØĢāĶ»ĘĘѵĮ· ×ØĢā9½šŹō¼°Ęä»ÆŗĻĪļĮ·Ļ°¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ĻĀĮŠĖµ·ØÖŠÕżČ·µÄŹĒ( )
A.ŌŚCu(NO3)2ŗĶAgNO3µÄ»ģŗĻČÜŅŗÖŠ¼ÓČėŅ»¶ØĮæµÄFe·Ū,³ä·Ö·“Ó¦ŗó,ĖłµĆµÄ¹ĢĢåæÉÄܽöĪŖCuŗĶFeµÄ»ģŗĻĪļ
B.øō¾ųæÕĘų,°ŃNa2O2Ķ¶ČėFeCl2ČÜŅŗÖŠ,¼ČÓŠĪŽÉ«ĘųĢåÉś³É,×īÖÕÓÖÓŠ°×É«³ĮµķÉś³É
C.½šŹōÄĘĶ¶Čėµ½FeCl3ČÜŅŗ,ÓŠŗŚÉ«Ģś·ŪÉś³É
D.NaHCO3ČÜŅŗÓėFe2(SO4)3ČÜŅŗ»ģŗĻ,¼ČÓŠĪŽÉ«ĘųĢåÉś³É,×īÖÕÓÖÓŠŗģŗÖÉ«³ĮµķÉś³É
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2014øßæ¼»Æѧ×ØĢāĶ»ĘĘѵĮ· ×ØĢā8µē»ÆѧŌĄķĮ·Ļ°¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ÓĆĖįŠŌĒāŃõČ¼ĮĻµē³ŲĪŖµēŌ“½ųŠŠµē½āµÄŹµŃé×°ÖĆĶ¼ČēĶ¼ĖłŹ¾,ĻĀĮŠĖµ·ØÖŠÕżČ·µÄŹĒ£Ø £©
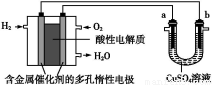
A.Č¼ĮĻµē³Ų¹¤×÷Ź±,Õż¼«·“Ó¦ĪŖ:O2+2H2O+4e-=4OH-
B.a¼«ŹĒĢś,b¼«ŹĒĶŹ±,b¼«Öš½„Čܽā,a¼«ÉĻÓŠĶĪö³ö
C.a¼«ŹĒ“ÖĶ,b¼«ŹĒ“æĶŹ±,a¼«Öš½„Čܽā,b¼«ÉĻÓŠĶĪö³ö
D.a”¢bĮ½¼«¾łŹĒŹÆÄ«Ź±,ŌŚĻąĶ¬Ģõ¼žĻĀa¼«²śÉśµÄĘųĢåÓėµē³ŲÖŠĻūŗĵÄH2Ģå»żĻąµČ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2014øßæ¼»Æѧ×ØĢāĶ»ĘĘѵĮ· ×ØĢā7µē½āÖŹČÜŅŗĮ·Ļ°¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗĢīæÕĢā
ŅŃÖŖH2AŌŚĖ®ÖŠ“ęŌŚŅŌĻĀĘ½ŗā:H2A H++HA-,HA-
H++HA-,HA- H++A2-”£»Ų“šŅŌĻĀĪŹĢā:
H++A2-”£»Ų“šŅŌĻĀĪŹĢā:
(1)NaHAČÜŅŗ (Ģī”°ĻŌĖįŠŌ”±”¢”°ĻŌ¼īŠŌ”±”¢”°ĻŌÖŠŠŌ”±»ņ”°Ėį¼īŠŌĪŽ·ØČ·¶Ø”±)”£
(2)ijĪĀ¶ČĻĀ,ČōĻņ0.1 mol/LµÄNaHAČÜŅŗÖŠµĪČė0.1 mol/L KOHČÜŅŗŹ¹»ģŗĻČÜŅŗÖŠc(H+)=c(OH-),Ōņ“ĖŹ±øĆ»ģŗĻČÜŅŗÖŠ,ĻĀĮŠ¹ŲĻµŅ»¶ØÕżČ·µÄŹĒ (Ģī×ÖÄø)”£
A.c(H+)”¤c(OH-)=1”Į10-14
B.c(Na+)+c(K+)=c(HA-)+2c(A2-)
C.c(Na+)£¾c(K+)
D.c(Na+)+c(K+)=0.05 mol/L
(3)ŅŃÖŖ³£ĪĀĻĀH2AµÄøĘŃĪ(CaA)±„ŗĶČÜŅŗÖŠ“ęŌŚŅŌĻĀĘ½ŗā:CaA(s) Ca2+(aq)+A2-(aq) ¦¤H£¾0
Ca2+(aq)+A2-(aq) ¦¤H£¾0
¢ŁĪĀ¶ČÉżøߏ±,Ksp (Ģī”°Ōö“ó”±”¢”°¼õŠ””±»ņ”°²»±ä”±,ĻĀĶ¬)”£
¢ŚµĪ¼ÓÉŁĮæÅØŃĪĖį,c(Ca2+) ”£
(4)ČōĻņCaAŠü×ĒŅŗÖŠ¼ÓČėCuSO4ČÜŅŗ,Éś³ÉŅ»ÖÖŗŚÉ«¹ĢĢåĪļÖŹ,Š“³öøĆ¹ż³ĢÖŠ·“Ó¦µÄĄė×Ó·½³ĢŹ½: ”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2014øßæ¼»Æѧ×ØĢāĶ»ĘĘѵĮ· ×ØĢā6»Æѧ·“Ó¦ĖŁĀŹŗĶ»ÆŃ§Ę½ŗāĮ·Ļ°¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ĪŖ¼õŠ”CO2¶Ō»·¾³µÄÓ°Ļģ,ŌŚ³«µ¼”°µĶĢ¼”±µÄĶ¬Ź±,»¹Šč¼ÓĒæ¶ŌCO2““ŠĀĄūÓƵÄŃŠ¾æ”£T1 ”ꏱ,½«9 mol CO2 ŗĶ12 mol H2³äČė3 LĆܱÕČŻĘ÷ÖŠ,·¢Éś·“Ó¦CO2(g)+3H2(g) CH3OH(g)+H2O(g) ¦¤H£¼0,ČŻĘ÷ÖŠCH3OHµÄĪļÖŹµÄĮæĖꏱ¼ä±ä»ÆČēĒśĻߢńĖłŹ¾,Ę½ŗāŹ±ČŻĘ÷ÄŚŃ¹ĒæĪŖp1”£øıäijŅ»Ģõ¼žÖŲŠĀ½ųŠŠÉĻŹö·“Ó¦,CH3OHµÄĪļÖŹµÄĮæĖꏱ¼ä±ä»ÆČēĒśĻߢņĖłŹ¾”£ĻĀĮŠĖµ·Ø“ķĪóµÄŹĒ£Ø £©
CH3OH(g)+H2O(g) ¦¤H£¼0,ČŻĘ÷ÖŠCH3OHµÄĪļÖŹµÄĮæĖꏱ¼ä±ä»ÆČēĒśĻߢńĖłŹ¾,Ę½ŗāŹ±ČŻĘ÷ÄŚŃ¹ĒæĪŖp1”£øıäijŅ»Ģõ¼žÖŲŠĀ½ųŠŠÉĻŹö·“Ó¦,CH3OHµÄĪļÖŹµÄĮæĖꏱ¼ä±ä»ÆČēĒśĻߢņĖłŹ¾”£ĻĀĮŠĖµ·Ø“ķĪóµÄŹĒ£Ø £©

A.ĒśĻߢņ¶ŌÓ¦µÄĢõ¼žøıäŹĒŌö“óŃ¹Ēæ
B.T2”ꏱ,ÉĻŹö·“Ó¦Ę½ŗā³£ŹżĪŖ0.42,ŌņT2£¾T1
C.ŌŚT1”ę,ČōĘšŹ¼Ź±ĻņČŻĘ÷ÖŠ³äČė5 mol CO2”¢5 mol H2”¢5 mol CH3OH(g)ŗĶ5 mol H2O(g),Ōņ“ļĘ½ŗāĒ°v(Õż)£¾v(Äę)
D.ŌŚT1”ę,ČōĘšŹ¼Ź±ĻņČŻĘ÷³äČė4.5 mol CO2”¢6 mol H2,Ę½ŗāŹ±ČŻĘ÷ÄŚŃ¹Ēæp=
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2014øßæ¼»Æѧ×ØĢāĶ»ĘĘѵĮ· ×ØĢā2»Æѧ³£ÓĆ¼ĘĮæ ČÜŅŗĮ·Ļ°¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ŌŚ200 mLijĮņĖįŃĪČÜŅŗÖŠŗ¬ÓŠ1.5NAøöĮņĖįøłĄė×Ó(NA±ķŹ¾°¢·ü¼ÓµĀĀŽ³£ŹżµÄÖµ),Ķ¬Ź±ŗ¬ÓŠNAøö½šŹōŃōĄė×Ó,ŌņøĆĮņĖįŃĪµÄĪļÖŹµÄĮæÅضČĪŖ£Ø £©
A.1 mol/L B.2.5 mol/L C.5 mol/L D.2 mol/L
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com