
| A£® | 10sŹ±£¬ŌŁ¼ÓČėŅ»¶ØĮæµÄD£¬Ę½ŗāĻņÓŅŅĘ¶Æ | |
| B£® | 10sŹ±ÓĆDĪļÖŹ±ķŹ¾µÄĖŁĀŹĪŖ0.04mol/£ØL•S£© | |
| C£® | 10sŹ±£¬ČŻĘ÷ÖŠBµÄÅضČĪŖ1.6mol•L-1 | |
| D£® | “ļµ½Ę½ŗāŹ±AµÄ×Ŗ»ÆĀŹĪŖ60%£¬ČōŅŖŌŚĻąĶ¬Ģõ¼žĻĀ·“Ó¦“ļµ½Ę½ŗāŹ±AµÄ×Ŗ»ÆĀŹČŌĪŖ60%£¬ĘšŹ¼¼ÓČėn£ØA£©=n£ØB£©¼“æÉ |
·ÖĪö A£®ĪļÖŹDĪŖ¹ĢĢ壬Ōö“óDµÄÓĆĮæ²»Ó°ĻģĘ½ŗāŅĘ¶Æ£»
B£®ĪļÖŹDĪŖ¹ĢĢ壬²»ÄÜÓĆDµÄÅØ¶Č±ä»ÆĮæ±ķŹ¾·“Ó¦ĖŁĀŹ£»
C£®øł¾Ż”÷c=v”Į”÷t¼ĘĖć”÷c£ØA£©£¬øł¾Ż·½³ĢŹ½¼ĘĖć”÷c£ØB£©£¬10sBµÄÅضČ=ĘšŹ¼ÅضČ-”÷c£ØB£©£»
D£®ŗćĪĀŗćČŻĻĀ£¬·“Ó¦Ē°ŗóĘųĢåĢå»ż²»±ä£¬ČōĘšŹ¼Ķ¶ĮĻĮæ±ČÓėŌĘ½ŗāĘšŹ¼Ķ¶ĮĻ±ČĻąµČ£¬ĪŖµČŠ§Ę½ŗā£¬Ę½ŗāŹ±Ķ¬ÖÖĪļÖŹµÄ×Ŗ»ÆĀŹĻąµČ£®
½ā“š ½ā£ŗA£®ĪļÖŹDĪŖ¹ĢĢ壬Ōö“óDµÄÓĆĮæ²»Ó°ĻģĘ½ŗāŅĘ¶Æ£¬¹ŹA“ķĪó£»
B£®ĪļÖŹDĪŖ¹ĢĢ壬²»ÄÜÓĆDµÄÅØ¶Č±ä»ÆĮæ±ķŹ¾·“Ó¦ĖŁĀŹ£¬¹ŹB“ķĪó£»
C£®Ę½ŗāŹ±”÷c£ØA£©=0.06mol/£ØL•s£©”Į10s=0.6mol/L£¬øł¾Ż·½³ĢŹ½æÉÖŖ”÷c£ØB£©=$\frac{1}{3}$”÷c£ØA£©=0.2mol/L£¬¹Ź10sBµÄÅضČ=$\frac{2mol}{2L}$-0.2mol/L=0.8mol/L£¬¹ŹC“ķĪó£»
D£®ŗćĪĀŗćČŻĻĀ£¬·“Ó¦Ē°ŗóĘųĢåĢå»ż²»±ä£¬ČōĘšŹ¼Ķ¶ĮĻĮæ±ČÓėŌĘ½ŗāĘšŹ¼Ķ¶ĮĻ±ČĻąµČ£¬ĪŖµČŠ§Ę½ŗā£¬Ę½ŗāŹ±Ķ¬ÖÖĪļÖŹµÄ×Ŗ»ÆĀŹĻąµČ£¬ŌĘ½ŗāĘšŹ¼Ķ¶ĮĻĮæn£ØA£©£ŗn£ØB£©=1£ŗ1£¬¹ŹĘšŹ¼¼ÓČėn£ØA£©=n£ØB£©¼“æÉ£¬¹ŹDÕżČ·£¬
¹ŹŃ”£ŗD£®
µćĘĄ ±¾Ģāæ¼²é»ÆŃ§Ę½ŗā¼ĘĖć”¢·“Ó¦ĖŁĀŹ¼°ÓŠ¹Ų¼ĘĖć”¢µČŠ§Ę½ŗāµČ£¬Ąķ½āµČŠ§Ę½ŗā¹ęĀÉ£ŗ1”¢ŗćĪĀŗćČŻ£¬·“Ó¦Ē°ŗóĘųĢåĢå»ż²»µČ£¬°“»Æѧ¼ĘĮæŹż×Ŗ»Æµ½Ņ»±ß£¬¶ŌÓ¦ĪļÖŹĀś×ćµČĮ棻·“Ó¦Ē°ŗóĘųĢåĢå»żĻąµČ£¬°“»Æѧ¼ĘĮæŹż×Ŗ»Æµ½Ņ»±ß£¬¶ŌÓ¦ĪļÖŹĀś×ćµČ±Č£¬2£ŗŗćĪĀŗćŃ¹£¬°“»Æѧ¼ĘĮæŹż×Ŗ»Æµ½Ņ»±ß£¬¶ŌÓ¦ĪļÖŹĀś×ćµČ±Č£®


 ŌĶĮæģ³µĻµĮŠ“š°ø
ŌĶĮæģ³µĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
| ĪĀ¶Č/”ę | 200 | 300 | 400 |
| K | 1.0 | 0.86 | 0.5 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
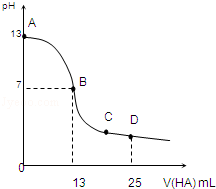 ³£ĪĀĻĀ£¬Ļņ25mL 0.1mol/L MOHČÜŅŗÖŠÖšµĪ¼ÓČė0.2mol/L HAČÜŅŗ£¬ĒśĻßČēĶ¼ĖłŹ¾£ØĢå»ż±ä»ÆŗöĀŌ²»¼Ę£©£®»Ų“šĻĀĮŠĪŹĢā£ŗ
³£ĪĀĻĀ£¬Ļņ25mL 0.1mol/L MOHČÜŅŗÖŠÖšµĪ¼ÓČė0.2mol/L HAČÜŅŗ£¬ĒśĻßČēĶ¼ĖłŹ¾£ØĢå»ż±ä»ÆŗöĀŌ²»¼Ę£©£®»Ų“šĻĀĮŠĪŹĢā£ŗ²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
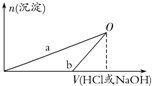 ijĶ¬Ń§ŃŠ¾æĀĮ¼°Ęä»ÆŗĻĪļµÄŠŌÖŹŹ±Éč¼ĘĮĖČēĻĀĮ½øöŹµŃé·½°ø£®
ijĶ¬Ń§ŃŠ¾æĀĮ¼°Ęä»ÆŗĻĪļµÄŠŌÖŹŹ±Éč¼ĘĮĖČēĻĀĮ½øöŹµŃé·½°ø£®| A£® | bĒśĻß±ķŹ¾µÄŹĒĻņXČÜŅŗÖŠ¼ÓČėNaOHČÜŅŗ | |
| B£® | ŌŚOµćŹ±Į½·½°øÖŠĖłµĆČÜŅŗÅضČĻąµČ | |
| C£® | ·½°ø¢ŚÖŠ¶ŌÓ¦µÄOµćHClĒ”ŗĆ·“Ó¦Ķź | |
| D£® | XČÜŅŗĻŌĖįŠŌ£¬YČÜŅŗĻŌ¼īŠŌ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
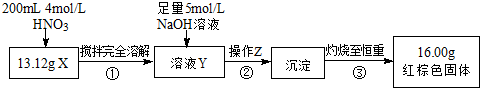
| ±ąŗÅ | ŹµŃé²Ł×÷ | ŹµŃéĻÖĻó |
| ¢Ł | ȔɣĮæŗŚÉ«·ŪÄ©X·ÅČėŹŌ¹Ü1ÖŠ£¬×¢ČėÅØŃĪĖį£¬Ī¢ČČ | ŗŚÉ«·ŪÄ©Öš½„Čܽā£¬ČÜŅŗ³Ź»ĘĀĢÉ«£»ÓŠĘųÅŻ²śÉś |
| ¢Ś | ĻņŹŌ¹Ü1ÖŠµĪ¼Ó¼øµĪKSCNČÜŅŗ£¬Õńµ“ | ČÜŅŗ³öĻÖŃŖŗģÉ« |
| ¢Ū | ĮķȔɣĮæŗŚÉ«·ŪÄ©X·ÅČėŹŌ¹Ü2ÖŠ£¬×¢Čė×ćĮæĮņĖįĶČÜŅŗ£¬Õńµ“£¬¾²ÖĆ | ÓŠ¼«ÉŁĮæŗģÉ«ĪļÖŹĪö³ö£¬ČŌÓŠ½Ļ¶ąŗŚÉ«¹ĢĢåĪ“Čܽā |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com