
| A. | 标准状况下,11.2 L乙醇中含有的碳氢键数为2.5NA | |
| B. | 常温常压下,28 g C2H4、CO的混合气体中含有碳原子的数目为1.5NA | |
| C. | 1mol Na2O2 固体中含阴阳离子的数目为3NA | |
| D. | 1 mol SO2与足量O2在一定条件下反应生成SO3,共转移2NA个电子 |
分析 A、标况下乙醇为液体;
B、求出混合气体的物质的量,然后根据乙烯中含2个碳原子而CO中含1个碳原子,且混合气体中两者的比例不明确来分析;
C、过氧化钠由2个钠离子和1个过氧根构成;
D、二氧化硫和氧气的反应为可逆反应.
解答 解:A、标况下乙醇为液体,故不能根据气体摩尔体积来计算其物质的量,故A错误;
B、28g乙烯和CO的混合气体的物质的量为1mol,而乙烯中含2个碳原子而CO中含1个碳原子,且由于混合气体中两者的比例不明确,故混合气体中含有的碳原子个数介于NA到2NA之间,但不一定是1.5NA个,故B错误;
C、过氧化钠由2个钠离子和1个过氧根构成,故1mol过氧化钠中含有的阴阳离子个数为3NA个,故C正确;
D、二氧化硫和氧气的反应为可逆反应,不能进行彻底,故转移的电子数小于2NA个,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:选择题
| A. | 胶体的分散质能通过滤纸孔隙 | |
| B. | 利用高纯度单质硅等可以制成光电池,将光能直接转化为电能 | |
| C. | 节日里燃放的烟花五彩缤纷,其实是碱金属以及锶、钡等金属化合物焰色反应所呈现的各种艳丽色彩 | |
| D. | 发生化学反应的充要条件是活分子之间发生“有效碰撞”,恒压条件下,对于一个可逆反应,正反应的活化能与逆反应的活化能之差是该反应的焓变,而一定不是反应热 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
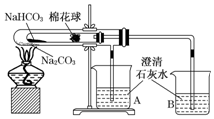 “套管实验”是将一个较小的玻璃仪器装入另外一个玻璃仪器中,经组装来完成原来需要两只或更多普通玻璃仪器进行的实验.因其具有许多优点,近年被广泛开发并应用于化学实验中.下述实验为“套管实验”,请观察如图所示实验装置,分析实验原理,回答下列问题:
“套管实验”是将一个较小的玻璃仪器装入另外一个玻璃仪器中,经组装来完成原来需要两只或更多普通玻璃仪器进行的实验.因其具有许多优点,近年被广泛开发并应用于化学实验中.下述实验为“套管实验”,请观察如图所示实验装置,分析实验原理,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,1 mol水的体积约为22.4 L | |
| B. | 1 mol任何气体体积均约为22.4 L | |
| C. | 在标准状况下,0.3 mol N2和0.7 mol O2混合气体总体积约为22.4 L | |
| D. | 通常状况下,1 mol N2的体积约为22.4 L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 还原剂与氧化剂的物质的量之比为3:1 | |
| B. | H2O既不作氧化剂又不作还原剂 | |
| C. | 每生成1 mol SO2转移4 mol电子 | |
| D. | S2Cl2只作氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸雨能加快桥梁、雕塑的腐蚀 | B. | 煤炭燃烧时,会向空气中排放SO2 | ||
| C. | 向高空排放粉尘,减少空气污染 | D. | 氮氧化物会形成光化学烟雾 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 达到化学平衡时,4v正(O2)=5v逆(NO) | |
| B. | 若单位时间内生成xmolNO的同时,消耗xmol NH3,则反应达到平衡状态 | |
| C. | 化学反应速率关系是:2v正(NH3)=3v正(H2O) | |
| D. | 达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 装置①是电解Na2SO4溶液联合生产硫酸和烧碱示意图,若气体甲,乙的体积比约为1:2,则离子交换膜c、d均为阴离子交换膜,产物丙为硫酸溶液 | |
| B. | 装置②是以肼(N2H4)为燃料的电池装置,a极的反应式:N2H4+4OH--4e-=N2↑+4H2O | |
| C. | 装置③是在待镀铁制品上镀铜的实验装置,电镀过程中电极Ⅱ上Cu2+放电而使溶液中Cu2+浓度逐渐变小 | |
| D. | 装置④是金属牺牲阳极的阴极保护法实验装置,加入K3[Fe(CN)6]溶液后,Fe电极附近会产生蓝色沉淀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com