
反应4 NH3 (气) + 5O2(气)![]() 4NO (气)
+ 6H2O (气),在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率
4NO (气)
+ 6H2O (气),在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率![]() (X
)可表示为( )
(X
)可表示为( )
A.![]()
![]() ) = 0.010 mol•L-1•s-1
B.
) = 0.010 mol•L-1•s-1
B.![]() (
(![]() ) = 0.0010 mol•L-1•s-1
) = 0.0010 mol•L-1•s-1
C.![]() (NO) = 0.0010 mol•L-1•s-1 D.
(NO) = 0.0010 mol•L-1•s-1 D.![]() (
(![]() ) = 0.045 mol•L-1•s-1
) = 0.045 mol•L-1•s-1
 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:
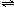 NH3(气)+HI(气) 2HI(气)
NH3(气)+HI(气) 2HI(气) H2(气)+I2(气)当反应达到平衡时[I2]=0.5摩/升,[HI]=4摩/升,则NH3的浓度为( )
H2(气)+I2(气)当反应达到平衡时[I2]=0.5摩/升,[HI]=4摩/升,则NH3的浓度为( )查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
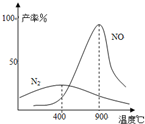 (2009?中山模拟)工业合成氨与制备硝酸一般可连续生产,流程如下:
(2009?中山模拟)工业合成氨与制备硝酸一般可连续生产,流程如下:
| 时间(h)浓度(mol/L) | 0 | 1 | 2 | 3 | 4 |
| N2 | 1.500 | 1.400 | 1.200 | C1 | C1 |
| H2 | 4.500 | 4.200 | 3.600 | C2 | C2 |
| NH3 | 0 | 0.200 | 0.600 | C3 | C3 |
| 1 |
| a |
| 1 |
| a |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 3 | 2 |
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:013
A.![]()
![]() ) = 0.010 mol•L-1•s-1
B.
) = 0.010 mol•L-1•s-1
B.![]() (
(![]() ) = 0.0010 mol•L-1•s-1
) = 0.0010 mol•L-1•s-1
C.![]() (NO) = 0.0010 mol•L-1•s-1 D.
(NO) = 0.0010 mol•L-1•s-1 D.![]() (
(![]() ) = 0.045 mol•L-1•s-1
) = 0.045 mol•L-1•s-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com