
| A、滴定过程中,初读数平视,末读数俯视 |
| B、锥形瓶用蒸馏水洗净后,未经干燥即进行滴定 |
| C、酸式滴定管未用标准盐酸润洗 |
| D、滴定前酸式滴定管尖嘴部分有气泡,滴定终止时气泡消失 |
| c(标准)×V(标准) |
| V(待测) |


科目:高中化学 来源: 题型:
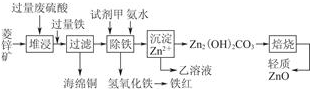
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 6.3 | 9.7 |
| Fe3+ | 1.5 | 3.2 |
| Zn2+ | 6.2 | 8.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
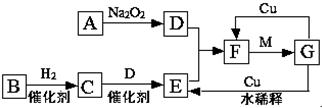 如图是由短周期元素组成的一些单质及其化合物之间的转化关系图.各方框表示有关的一种反应物或生成物(某些物质已经略去),其中A、B、D在常温下均为无色无刺激性气味的气体,C是使湿润的红色石蕊试纸变蓝的气体,M是最常见的无色液体.
如图是由短周期元素组成的一些单质及其化合物之间的转化关系图.各方框表示有关的一种反应物或生成物(某些物质已经略去),其中A、B、D在常温下均为无色无刺激性气味的气体,C是使湿润的红色石蕊试纸变蓝的气体,M是最常见的无色液体.查看答案和解析>>
科目:高中化学 来源: 题型:
 高锰酸钾是实验中常见的氧化剂.KMnO4溶液在中性或碱性条件下分解速度较慢,酸性条件下水溶液稳定性较差,有二氧化锰和氧气析出,见光分解速率加快.
高锰酸钾是实验中常见的氧化剂.KMnO4溶液在中性或碱性条件下分解速度较慢,酸性条件下水溶液稳定性较差,有二氧化锰和氧气析出,见光分解速率加快.| 实验序号 | KMnO4 溶液体积/mL |
| I | 20.02 |
| II | 19.98 |
| III | 22.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
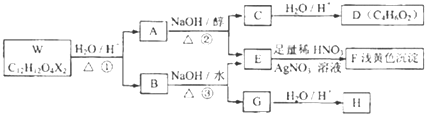

| 醇 |
| 浓H2SO4/△④ |
| 催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CO2+OH-→HCO3- |
| B、AlO2-+CO2+2H2O→Al(OH)3↓+HCO3- |
| C、2AlO2-+CO2+3H2O↓→2Al(OH)3↓+CO32- |
| D、CO32-+CO2+2H2O→2HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、稀释浓硫酸时,将水沿器壁缓慢注入浓硫酸中,同时不断搅拌,防止酸液溅出 |
| B、过滤时,滤纸的边缘要高于漏斗的边缘,防止液体从滤纸和漏斗壁之间流下 |
| C、胶头滴管的尖嘴部分直接伸入试管里滴加液体,避免液体溅出到试管口上 |
| D、做焰色反应实验用的铂丝用稀盐酸洗涤后,再在酒精灯火焰上灼烧到没有颜色才可使用 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com