
| 选项 | 化学反应及其离子方程式 | 评价 |
| 1 | 醋酸钠溶于水:CH3COO-+H2O═CH3COOH+OH- | 正确 |
| 2 | 在氢氧化钠溶液中滴加少量氯化铝:Al3++3OH-═Al(OH)3↓ | 错误,Al(OH)3能溶于氢氧化钠 |
| 3 | 铁加入到过量的稀硝酸溶液中:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O | 正确 |
| 4 | 在硫酸铝钾溶液中滴加氢氧化钡溶液至沉淀的物质的量最多: 3Ba2++6OH-+2Al3++3SO42-═3BaSO4↓+2Al(OH)3↓ |
错误,Al3+与OH-的化学计量数之比为1:3 |
| A、1 | B、2 | C、3 | D、4 |


科目:高中化学 来源: 题型:
 X、Y、Z、W、R.均为前四周期元素且原子序数依次增大,X的基态原子核外有7种不同运动状态的电子,Y原子最外层有2对成对电子,Z的原子序数为Y的原子序数的2倍,W3+的基态离子3d轨道为半充满状态,R的氢氧化物悬浊液可用于检验葡萄糖的存在.
X、Y、Z、W、R.均为前四周期元素且原子序数依次增大,X的基态原子核外有7种不同运动状态的电子,Y原子最外层有2对成对电子,Z的原子序数为Y的原子序数的2倍,W3+的基态离子3d轨道为半充满状态,R的氢氧化物悬浊液可用于检验葡萄糖的存在.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将过量NaOH溶液滴入Ca(HCO3)2溶液中:Ca2++HCO3-+OH-═CaCO3↓+H2O |
| B、三氯化铁溶液中通入硫化氢气体:2Fe3++3H2S═Fe2S3↓+6H+ |
| C、用稀硝酸浸泡做过银镜反应的试管:Ag+2H++NO3-═Ag++NO2↑+H2O |
| D、4mol?L-1的NaAlO2溶液和7mol?L-1的HCl等体积互相均匀混合:4AlO2-+7H++H2O═3Al(OH)3↓+Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2O2与H2O反应:Na2O2+H2O=2Na++2OH-+O2↑ |
| B、硫酸铝与过量氨水反应:Al3++4NH3?H2O=AlO2-+4NH4++2H2O |
| C、用FeCl3溶液腐蚀铜线路板:Cu+Fe3+=Cu2++Fe2+ |
| D、NO2溶于水:3NO2+H2O=2H++2NO3-+NO |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(NH4+)>c(Cl-)>c(H+)>c(OH-) |
| B、c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
| C、c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| D、c(NH4+)+c(H+)=c(Cl-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、未加入稀氢氧化钠之前c(CH3COO-)<c(CH3COOH) |
| B、加稀氢氧化钠后溶液中[c(CH3COO-)?c(H+)]/c(CH3COOH)变大 |
| C、加稀氢氧化钠后CH3COOH的电离程度减小,但c( OH-)增大 |
| D、pH=7时,溶液中c( Na+)=c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、KIO3+6HI=KI+3H2O+3I2,生成3mol I2转移电子的总数为5NA |
| B、标准状况下,5.6L氧气中含有O的总数为0.5NA |
| C、25℃时,pH=13的Ba(OH)2溶液1.0L中含有OH-总数为0.1NA |
| D、20g重水(D2O)中所含电子总数为8NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
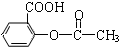 ).为测定某解热镇痛药阿斯
).为测定某解热镇痛药阿斯 冷却后用0.10mol/L HCl溶液返滴过量的NaOH,消耗该HCl溶液25.00mL.
冷却后用0.10mol/L HCl溶液返滴过量的NaOH,消耗该HCl溶液25.00mL.查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com